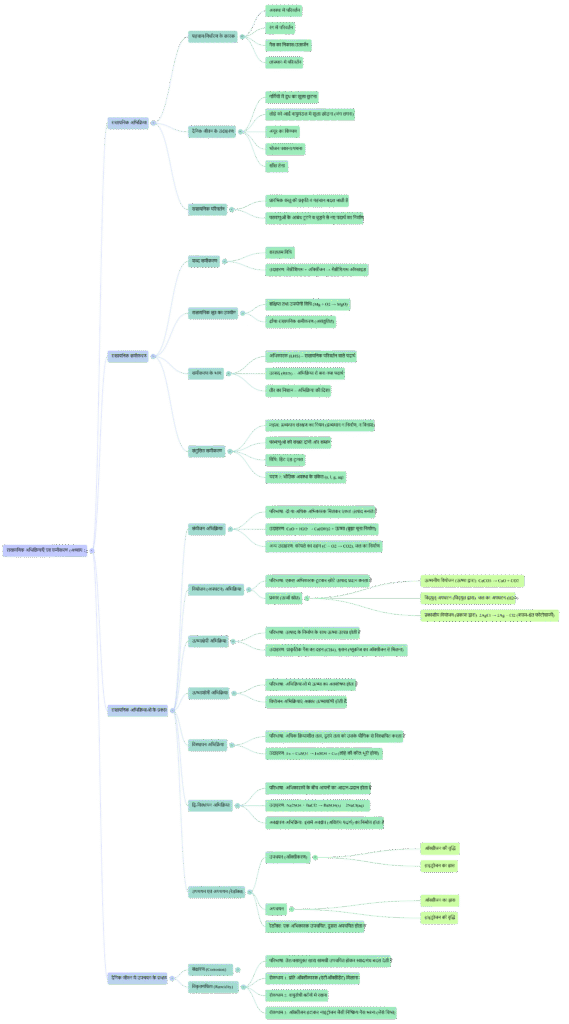
रासायनिक अभिक्रियाओं के प्रकार: एक सरल परिचय
प्रस्तावना: आपके चारों ओर का रसायन विज्ञान
क्या आपने कभी सोचा है कि गर्मियों में दूध कमरे के तापमान पर खराब क्यों हो जाता है, लोहे की कील पर जंग कैसे लग जाती है, या हमारा शरीर भोजन को कैसे पचाता है? ये सभी हमारे दैनिक जीवन में होने वाली रासायनिक अभिक्रियाओं के उदाहरण हैं। सरल शब्दों में, जब कोई रासायनिक परिवर्तन होता है, तो इसका अर्थ है कि “प्रारंभिक वस्तु की प्रकृति तथा पहचान कुछ न कुछ बदल जाती है।”
किसी भी रासायनिक अभिक्रिया में, जो पदार्थ परिवर्तन से गुजरते हैं उन्हें अभिकारक (reactants) कहा जाता है, और जो नए पदार्थ बनते हैं उन्हें उत्पाद (products) कहा जाता है। रासायनिक समीकरणों को और अधिक जानकारीपूर्ण बनाने के लिए, हम अभिकारकों और उत्पादों की भौतिक अवस्था को दर्शाने के लिए प्रतीकों का उपयोग करते हैं: ठोस के लिए (s), द्रव के लिए (l), गैस के लिए (g), और जलीय विलयन (जल में घुले हुए) के लिए (aq)।
आइए, अब इन रोचक अभिक्रियाओं के मुख्य प्रकारों को विस्तार से समझते हैं।
——————————————————————————–
1. संयोजन अभिक्रिया: जब चीजें एक साथ जुड़ती हैं
संयोजन अभिक्रिया को उसकी परिभाषा से सबसे अच्छी तरह समझा जा सकता है, जो बहुत सीधी है:
ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं उसे संयोजन अभिक्रिया कहते हैं।
इसका एक उत्कृष्ट उदाहरण कैल्शियम ऑक्साइड (बिना बुझा चूना) की जल के साथ अभिक्रिया है। जब आप चूने में पानी मिलाते हैं, तो वे मिलकर कैल्शियम हाइड्रॉक्साइड (बुझा हुआ चूना) बनाते हैं।
CaO(s) + H2O(l) → Ca(OH)2(aq) + ऊष्मा
इस उदाहरण से दो मुख्य बातें सीखी जा सकती हैं:
- दो अभिकारक, एक उत्पाद: यहाँ, कैल्शियम ऑक्साइड (CaO) और जल (H₂O) दो अलग-अलग अभिकारक हैं जो मिलकर केवल एक उत्पाद, कैल्शियम हाइड्रॉक्साइड (Ca(OH)₂) बनाते हैं।
- ऊष्मा का उत्सर्जन: आपने ध्यान दिया होगा कि समीकरण में “+ ऊष्मा” लिखा है। इसका मतलब है कि उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है। ऐसी अभिक्रियाओं को ऊष्माक्षेपी (exothermic) अभिक्रिया कहा जाता है।
संयोजन अभिक्रिया के ठीक विपरीत, वियोजन अभिक्रिया में एक एकल पदार्थ टूटकर कई छोटे पदार्थ बनाता है।
——————————————————————————–
2. वियोजन अभिक्रिया: जब चीजें टूट जाती हैं
वियोजन अभिक्रिया वह है जिसमें, स्रोत के शब्दों में, “एकल अभिकर्मक टूट कर छोटे-छोटे उत्पाद प्रदान करता है।” इस प्रकार, यह संयोजन अभिक्रिया के ठीक विपरीत कार्य करती है, जहाँ कई अभिकारक मिलकर एक उत्पाद बनाते हैं।
उदाहरण के लिए, जब फेरस सल्फेट के क्रिस्टल को गर्म किया जाता है, तो यह तीन छोटे उत्पादों में टूट जाता है: फेरिक ऑक्साइड, सल्फर डाइऑक्साइड, और सल्फर ट्राइऑक्साइड।
2FeSO4(s) –(ऊष्मा)–> Fe2O3(s) + SO2(g) + SO3(g)
इस अभिक्रिया में बंधनों को तोड़ने के लिए ऊर्जा की आवश्यकता होती है, जो इस मामले में ऊष्मा के रूप में प्रदान की जाती है। ऊष्मा द्वारा की गई वियोजन अभिक्रिया को ऊष्मीय वियोजन कहा जाता है। कैल्शियम कार्बोनेट (चूना पत्थर) का ऊष्मा देने पर कैल्शियम ऑक्साइड और कार्बन डाइऑक्साइड में टूटना भी ऊष्मीय वियोजन का एक और प्रमुख उदाहरण है।
अब तक हमने पदार्थों के जुड़ने और टूटने के बारे में जाना। अब हम देखेंगे कि क्या होता है जब एक तत्व दूसरे को उसकी जगह से हटा देता है।
——————————————————————————–
3. विस्थापन अभिक्रिया: स्थान की अदला-बदली
विस्थापन अभिक्रिया तब होती है जब एक अधिक क्रियाशील तत्व किसी यौगिक से कम क्रियाशील तत्व को विस्थापित कर देता है या हटा देता है।
इसका एक क्लासिक उदाहरण तब होता है जब एक लोहे की कील को कॉपर सल्फेट के नीले विलयन में डुबोया जाता है। आप दो प्रमुख परिवर्तन देखेंगे:
| अवलोकन (Observation) | कारण (Reason) |
| विलयन का नीला रंग मलीन हो गया | लोहे ने कॉपर को विस्थापित कर आयरन सल्फेट बनाया, जिसका रंग अलग होता है। |
| लोहे की कील भूरी हो गई | विस्थापित कॉपर धातु लोहे की कील पर जमा हो गई। |
इस प्रक्रिया को दर्शाने वाला रासायनिक समीकरण इस प्रकार है:
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
यहाँ, अधिक क्रियाशील होने के कारण लोहे (Fe) ने कॉपर सल्फेट (CuSO₄) के विलयन से कॉपर (Cu) को उसकी जगह से हटा दिया।
विस्थापन अभिक्रिया में जहाँ एक तत्व दूसरे को हटाता है, वहीं द्विविस्थापन अभिक्रिया में दो यौगिकों के बीच आयनों का पूरा आदान-प्रदान होता है।
——————————————————————————–
4. द्विविस्थापन अभिक्रिया: एक पूर्ण आदान-प्रदान
इस प्रकार की अभिक्रिया को स्रोत में इस प्रकार परिभाषित किया गया है: “वे अभिक्रियाएँ, जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है, उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।”
सोडियम सल्फेट और बेरियम क्लोराइड के विलयनों को मिलाने पर यह अभिक्रिया होती है। जब इन दोनों पारदर्शी विलयनों को मिलाया जाता है, तो बेरियम सल्फेट का एक सफेद, अघुलनशील पदार्थ बनता है, जिसे अवक्षेप (precipitate) कहा जाता है।
रासायनिक समीकरण इस प्रकार है, जिसमें बेरियम सल्फेट को अवक्षेप के रूप में दर्शाया गया है:
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl(aq)
इस अभिक्रिया में, सोडियम (Na⁺) और बेरियम (Ba²⁺) आयन अपने स्थानों की अदला-बदली करते हैं, जिससे दो नए यौगिक बनते हैं।
आयनों के आदान-प्रदान से हटकर, अब हम अभिक्रियाओं के एक ऐसे वर्ग को देखेंगे जो ऑक्सीजन के जुड़ने या हटने पर केंद्रित है।
——————————————————————————–
5. उपचयन-अपचयन (रेडॉक्स) अभिक्रिया: ऑक्सीजन का खेल
उपचयन और अपचयन दो प्रक्रियाएं हैं जो हमेशा एक साथ होती हैं। इन्हें ऑक्सीजन के संदर्भ में आसानी से समझा जा सकता है:
- उपचयन (Oxidation): जब किसी पदार्थ में अभिक्रिया के समय ऑक्सीजन की वृद्धि होती है।
- अपचयन (Reduction): जब किसी पदार्थ में अभिक्रिया के समय ऑक्सीजन का ह्रास होता है।
आइए इसे कॉपर के उदाहरण से समझें। जब कॉपर पाउडर को गर्म किया जाता है, तो यह ऑक्सीजन के साथ मिलकर कॉपर ऑक्साइड बनाता है—यह उपचयन है।
उपचयन (कॉपर में ऑक्सीजन जुड़ता है)
2Cu + O2 –(तापन)–> 2CuO
अब, यदि हम इस गर्म कॉपर ऑक्साइड (CuO) पर हाइड्रोजन गैस प्रवाहित करें, तो ऑक्सीजन हट जाती है और हमें वापस कॉपर मिल जाता है—यह अपचयन है।
अपचयन (कॉपर ऑक्साइड से ऑक्सीजन हटता है)
CuO + H2 –(तापन)–> Cu + H2O
इस अभिक्रिया में, कॉपर ऑक्साइड का अपचयन हो रहा है (क्योंकि यह ऑक्सीजन खो रहा है) जबकि हाइड्रोजन का उपचयन हो रहा है (क्योंकि यह ऑक्सीजन प्राप्त कर रहा है)। चूँकि ये दोनों प्रक्रियाएँ एक साथ होती हैं, इसलिए इन्हें उपचयन-अपचयन या रेडॉक्स अभिक्रिया कहा जाता है। हमारे दैनिक जीवन में संक्षारण (जैसे लोहे पर जंग लगना) उपचयन अभिक्रिया का एक सामान्य उदाहरण है।
——————————————————————————–
निष्कर्ष: अभिक्रियाओं को एक साथ लाना
हमने रासायनिक अभिक्रियाओं के पाँच मूलभूत प्रकारों का पता लगाया है। संयोजन में पदार्थ जुड़ते हैं, जबकि इसकी विपरीत प्रक्रिया, वियोजन, में वे टूट जाते हैं। विस्थापन में एक तत्व दूसरे को प्रतिस्थापित करता है, जो द्विविस्थापन में आयनों के पूर्ण आदान-प्रदान के रूप में और विकसित होता है। अंत में, उपचयन-अपचयन अभिक्रियाएं ऑक्सीजन के आदान-प्रदान के माध्यम से होने वाले परिवर्तनों को नियंत्रित करती हैं।
इन मूलभूत प्रकारों को समझना रसायन विज्ञान की आकर्षक दुनिया के रहस्यों को खोलने की पहली कुंजी है।
रासायनिक समीकरणों को संतुलित करना सीखें: हिट एंड ट्रायल विधि
परिचय: हम समीकरणों को संतुलित क्यों करते हैं?
रासायनिक समीकरण रासायनिक अभिक्रियाओं के लिए व्यंजनों की तरह होते हैं। वे हमें बताते हैं कि कौन से अभिकारक मिलकर कौन से उत्पाद बनाते हैं। इन व्यंजनों के लिए एक मौलिक नियम है: द्रव्यमान के संरक्षण का नियम। यह नियम बस इतना कहता है कि, “किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है न ही विनाश।”
इस कानून का रासायनिक समीकरणों के लिए एक सीधा परिणाम है: प्रत्येक तत्व के परमाणुओं की संख्या अभिकारक पक्ष और उत्पाद पक्ष दोनों पर समान होनी चाहिए। इस संतुलन को सुनिश्चित करने के लिए हम “हिट एंड ट्रायल” नामक एक व्यवस्थित विधि का उपयोग करते हैं।
1.0 प्रारंभिक बिंदु: हमारा असंतुलित समीकरण
1.1. उदाहरण का परिचय
इस पूर्वाभ्यास के लिए, हम निम्नलिखित रासायनिक समीकरण का उपयोग करेंगे:
Fe + H2O → Fe3O4 + H2
- बाईं ओर (LHS): अभिकारक
- दाईं ओर (RHS): उत्पाद
1.2. यह असंतुलित क्यों है?
किसी अभिक्रिया का ऐसा रासायनिक समीकरण ढाँचा रासायनिक समीकरण (skeletal chemical equation) कहलाता है। यह देखने के लिए कि यह असंतुलित क्यों है, आइए प्रत्येक पक्ष पर प्रत्येक तत्व के परमाणुओं की संख्या की गणना करें।
| तत्व (Element) | अभिकारकों में परमाणुओं की संख्या (LHS) | उत्पादों में परमाणुओं की संख्या (RHS) |
| Fe | 1 | 3 |
| H | 2 | 2 |
| O | 1 | 4 |
जैसा कि आप देख सकते हैं, आयरन (Fe) और ऑक्सीजन (O) के परमाणुओं की संख्या दोनों तरफ बराबर नहीं है। यही वह समस्या है जिसे हमें हल करने की आवश्यकता है। आइए चरण-दर-चरण संतुलन प्रक्रिया शुरू करें।
2.0 चरण-दर-चरण संतुलन: “हिट एंड ट्रायल” विधि
2.1. चरण 1: सूत्रों की सुरक्षा करें
पहला कदम प्रत्येक सूत्र के चारों ओर एक बॉक्स बनाना है। यह सुनिश्चित करता है कि हम यौगिकों के रासायनिक श्रृंगार को नहीं बदलते हैं। नियम यह है: “समीकरण को संतुलित करते समय बॉक्स के अंदर कुछ भी परिवर्तन नहीं कीजिए।”
[Fe] + [H2O] → [Fe3O4] + [H2]
2.2. चरण 2: सबसे पहले सबसे जटिल यौगिक को संतुलित करें
सुविधा के लिए, संतुलन की शुरुआत उस यौगिक से करना सबसे अच्छा होता है जिसमें सबसे अधिक परमाणु हों, चाहे वह अभिकारक हो या उत्पाद। इस मामले में, वह Fe3O4 है। उस यौगिक के भीतर, हम सबसे अधिक परमाणुओं वाले तत्व से शुरू करते हैं: ऑक्सीजन (O)।
- समस्या: LHS (H2O में) पर 1 ऑक्सीजन परमाणु है और RHS (Fe3O4 में) पर 4 ऑक्सीजन परमाणु हैं।
- समाधान: ऑक्सीजन परमाणुओं को संतुलित करने के लिए, LHS पर H2O के सामने 4 का गुणांक (coefficient) रखें।
अब समीकरण इस प्रकार दिखता है:
Fe + 4H2O → Fe3O4 + H2
यह अब एक आंशिक रूप से संतुलित समीकरण है।
2.3. चरण 3: अगले तत्व को संतुलित करें (हाइड्रोजन)
अब, Fe और H अभी भी असंतुलित हैं। आइए हाइड्रोजन (H) को संतुलित करें।
- नई समस्या: पिछले चरण ने एक नई असंतुलन पैदा किया। अब LHS पर 4 x 2 = 8 हाइड्रोजन परमाणु हैं, लेकिन RHS पर केवल 2 हैं।
- समाधान: हाइड्रोजन परमाणुओं को संतुलित करने के लिए, RHS पर H2 के सामने 4 का गुणांक रखें।
नया आंशिक रूप से संतुलित समीकरण है:
Fe + 4H2O → Fe3O4 + 4H2
2.4. चरण 4: अंतिम तत्व को संतुलित करें (आयरन)
अंतिम असंतुलित तत्व आयरन (Fe) है।
- समस्या: LHS पर 1 आयरन परमाणु है लेकिन RHS पर 3 हैं।
- समाधान: आयरन परमाणुओं को संतुलित करने के लिए, LHS पर Fe के सामने 3 का गुणांक रखें।
नया समीकरण है:
3Fe + 4H2O → Fe3O4 + 4H2
अब, समीकरण के सभी तत्वों के गुणांक निर्धारित हो चुके हैं।
2.5. चरण 5: अंतिम सत्यापन
अंतिम चरण यह सत्यापित करना है कि समीकरण वास्तव में संतुलित है या नहीं, इसके लिए परमाणु गणना की एक बार फिर से जाँच करें।
| तत्व (Element) | अभिकारकों में परमाणुओं की संख्या (LHS) | उत्पादों में परमाणुओं की संख्या (RHS) |
| Fe | 3 | 3 |
| H | 8 (4 x 2) | 8 (4 x 2) |
| O | 4 (4 x 1) | 4 |
चूंकि प्रत्येक तत्व के परमाणुओं की संख्या दोनों तरफ बराबर है, इसलिए समीकरण अब संतुलित है। अब, आइए समीकरण को और अधिक जानकारीपूर्ण बनाने के लिए एक अंतिम, वैकल्पिक चरण जोड़ें।
3.0 और अधिक विवरण जोड़ना: भौतिक अवस्थाएँ
एक रासायनिक समीकरण को अधिक सूचनापूर्ण बनाने के लिए, हम प्रत्येक पदार्थ की भौतिक अवस्था को शामिल कर सकते हैं।
- (s) ठोस के लिए
- (l) द्रव के लिए
- (g) गैस के लिए
- (aq) जलीय के लिए (जब कोई पदार्थ पानी में घुला हो)
इन संकेतों को जोड़ने पर, हमारा अंतिम, पूरी तरह से जानकारीपूर्ण संतुलित समीकरण है:
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
ध्यान दें कि H2O को (g) के रूप में चिह्नित किया गया है, जो यह दर्शाता है कि इस अभिक्रिया में पानी का उपयोग भाप के रूप में किया गया था।
4.0 निष्कर्ष: आपने अपना पहला समीकरण संतुलित कर लिया है!
संक्षेप में, “हिट एंड ट्रायल” विधि द्रव्यमान के संरक्षण के नियम को संतुष्ट करने के लिए गुणांकों को व्यवस्थित रूप से समायोजित करने की एक प्रक्रिया है। इस विधि को ‘हिट एंड ट्रायल’ इसलिए कहा जाता है क्योंकि हम समीकरण को संतुलित करने के लिए सबसे छोटी पूर्णांक संख्याओं के गुणांकों का उपयोग करके प्रयत्न करते हैं। इस पूर्वाभ्यास का पालन करके, आपने रासायनिक समीकरणों को सटीक रूप से संतुलित करने के लिए एक मौलिक कौशल सीखा है।
रासायनिक अभिक्रियाएँ एवं समीकरण
लघु-उत्तरीय प्रश्नोत्तरी
निम्नलिखित प्रश्नों के उत्तर 2-3 वाक्यों में दें।
- रासायनिक अभिक्रिया को कैसे पहचाना जा सकता है? चार प्रमुख प्रेक्षणों का उल्लेख करें।
- द्रव्यमान संरक्षण का नियम क्या है और यह रासायनिक समीकरणों को संतुलित करने से कैसे संबंधित है?
- ऊष्माक्षेपी और ऊष्माशोषी अभिक्रियाओं के बीच क्या अंतर है? प्रत्येक का एक उदाहरण दें।
- संयोजन अभिक्रिया को परिभाषित करें। कोयले के दहन का रासायनिक समीकरण लिखें।
- वियोजन अभिक्रिया संयोजन अभिक्रिया के विपरीत क्यों होती है? एक उदाहरण के साथ समझाएं।
- विस्थापन अभिक्रिया क्या है? उस अभिक्रिया के लिए एक समीकरण प्रदान करें जहाँ लोहा कॉपर सल्फेट विलयन से कॉपर को विस्थापित करता है।
- द्विविस्थापन अभिक्रिया में आयनों का आदान-प्रदान कैसे होता है? एक अवक्षेपण अभिक्रिया का उदाहरण दें।
- उपचयन और अपचयन को ऑक्सीजन के योग या ह्रास के संदर्भ में परिभाषित करें।
- संक्षारण क्या है? लोहे और चांदी पर इसके प्रभावों के दो उदाहरण दीजिए।
- चिप्स निर्माता अपने बैग से ऑक्सीजन निकालकर नाइट्रोजन क्यों भरते हैं? इस प्रक्रिया का नाम बताइए।
उत्तर कुंजी
- रासायनिक अभिक्रिया को कैसे पहचाना जा सकता है? चार प्रमुख प्रेक्षणों का उल्लेख करें। एक रासायनिक अभिक्रिया की पहचान अवस्था में परिवर्तन, रंग में परिवर्तन, गैस का निकास या उत्सर्जन, और तापमान में परिवर्तन जैसे प्रेक्षणों से की जा सकती है। ये परिवर्तन इंगित करते हैं कि एक रासायनिक परिवर्तन हुआ है।
- द्रव्यमान संरक्षण का नियम क्या है और यह रासायनिक समीकरणों को संतुलित करने से कैसे संबंधित है? द्रव्यमान संरक्षण के नियम के अनुसार, किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है और न ही विनाश। इसका मतलब है कि अभिकारक तत्वों का कुल द्रव्यमान उत्पाद तत्वों के कुल द्रव्यमान के बराबर होना चाहिए। इसलिए, अभिक्रिया के पहले और बाद में प्रत्येक तत्व के परमाणुओं की संख्या को समान रखने के लिए रासायनिक समीकरणों को संतुलित करना आवश्यक है।
- ऊष्माक्षेपी और ऊष्माशोषी अभिक्रियाओं के बीच क्या अंतर है? प्रत्येक का एक उदाहरण दें। ऊष्माक्षेपी अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है, जिससे अभिक्रिया मिश्रण गर्म हो जाता है (उदाहरण: प्राकृतिक गैस का दहन)। इसके विपरीत, ऊष्माशोषी अभिक्रियाओं में ऊष्मा का अवशोषण होता है (उदाहरण: ऊष्मा द्वारा कैल्शियम कार्बोनेट का वियोजन)।
- संयोजन अभिक्रिया को परिभाषित करें। कोयले के दहन का रासायनिक समीकरण लिखें। एक संयोजन अभिक्रिया वह होती है जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं। कोयले का दहन एक संयोजन अभिक्रिया का एक उदाहरण है, जहाँ ठोस कार्बन ऑक्सीजन गैस के साथ मिलकर कार्बन डाइऑक्साइड गैस बनाता है। समीकरण है: C(s) + O2(g) → CO2(g)।
- वियोजन अभिक्रिया संयोजन अभिक्रिया के विपरीत क्यों होती है? एक उदाहरण के साथ समझाएं। वियोजन अभिक्रिया को संयोजन अभिक्रिया के विपरीत कहा जाता है क्योंकि इसमें एक एकल अभिकारक टूटकर दो या दो से अधिक छोटे-छोटे उत्पाद प्रदान करता है। उदाहरण के लिए, ऊष्मा देने पर कैल्शियम कार्बोनेट (एकल अभिकारक) का कैल्शियम ऑक्साइड और कार्बन डाइऑक्साइड (दो उत्पाद) में वियोजित होना: CaCO3(s) → CaO(s) + CO2(g)।
- विस्थापन अभिक्रिया क्या है? उस अभिक्रिया के लिए एक समीकरण प्रदान करें जहाँ लोहा कॉपर सल्फेट विलयन से कॉपर को विस्थापित करता है। विस्थापन अभिक्रिया वह अभिक्रिया है जिसमें एक तत्व दूसरे तत्व को उसके यौगिक के विलयन से विस्थापित कर देता है या हटा देता है। जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोया जाता है, तो अधिक क्रियाशील लोहा कॉपर को विस्थापित कर देता है। समीकरण है: Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)।
- द्विविस्थापन अभिक्रिया में आयनों का आदान-प्रदान कैसे होता है? एक अवक्षेपण अभिक्रिया का उदाहरण दें। द्विविस्थापन अभिक्रियाओं में, अभिकारकों के बीच आयनों का आदान-प्रदान होता है जिससे नए यौगिक बनते हैं। एक उदाहरण सोडियम सल्फेट और बेरियम क्लोराइड के बीच की अभिक्रिया है, जहाँ Ba²⁺ और SO₄²⁻ आयनों की अभिक्रिया से बेरियम सल्फेट (BaSO₄) का एक अघुलनशील अवक्षेप बनता है।
- उपचयन और अपचयन को ऑक्सीजन के योग या ह्रास के संदर्भ में परिभाषित करें। जब किसी अभिक्रिया के दौरान किसी पदार्थ में ऑक्सीजन की वृद्धि होती है या हाइड्रोजन का ह्रास होता है, तो उसे उपचयन कहते हैं। इसके विपरीत, जब किसी पदार्थ में ऑक्सीजन का ह्रास होता है या हाइड्रोजन की वृद्धि होती है, तो उसे अपचयन कहते हैं।
- संक्षारण क्या है? लोहे और चांदी पर इसके प्रभावों के दो उदाहरण दीजिए। संक्षारण वह प्रक्रिया है जिसमें कोई धातु अपने आस-पास अम्ल, आर्द्रता आदि के संपर्क में आने पर धीरे-धीरे नष्ट हो जाती है। लोहे की वस्तुओं पर भूरे रंग की परत चढ़ना (जंग लगना) और चांदी के ऊपर काली पर्त का चढ़ना संक्षारण के सामान्य उदाहरण हैं।
- चिप्स निर्माता अपने बैग से ऑक्सीजन निकालकर नाइट्रोजन क्यों भरते हैं? इस प्रक्रिया का नाम बताइए। चिप्स निर्माता चिप्स की थैली में से ऑक्सीजन हटाकर उसमें नाइट्रोजन जैसी कम सक्रिय गैस भर देते हैं ताकि चिप्स का उपचयन न हो सके, जिससे वे विकृतगंधी होने से बच जाते हैं। इस स्थिति को विकृतगंधिता कहते हैं, जिसमें तेल एवं वसा उपचयित होने पर उनके स्वाद तथा गंध बदल जाते हैं।
निबंधात्मक प्रश्न
- ‘हिट एंड ट्रायल’ विधि का उपयोग करके रासायनिक समीकरण को संतुलित करने की चरण-दर-चरण प्रक्रिया का वर्णन करें। Fe + H₂O → Fe₃O₄ + H₂ समीकरण को संतुलित करके अपनी समझ का प्रदर्शन करें।
- विभिन्न प्रकार की रासायनिक अभिक्रियाओं (संयोजन, वियोजन, विस्थापन, और द्विविस्थापन) की व्याख्या करें। प्रत्येक प्रकार की अभिक्रिया के लिए एक संतुलित रासायनिक समीकरण के साथ एक विशिष्ट उदाहरण प्रदान करें।
- रेडॉक्स अभिक्रिया क्या है? एक उदाहरण का उपयोग करके उपचयन और अपचयन की प्रक्रियाओं की व्याख्या करें, और उपचयित तथा अपचयित पदार्थों की पहचान करें।
- दैनिक जीवन में उपचयन अभिक्रियाओं के दो प्रमुख प्रभावों, संक्षारण और विकृतगंधिता का विस्तार से वर्णन करें। इन प्रभावों को रोकने के उपायों पर चर्चा करें।
- तीन अलग-अलग प्रकार की वियोजन अभिक्रियाओं (ऊष्मीय, वैद्युत, और प्रकाशीय) का वर्णन करें। प्रत्येक के लिए एक उपयुक्त क्रियाकलाप और संतुलित रासायनिक समीकरण का उल्लेख करें।
शब्दावली
| शब्द | परिभाषा |
| अभिकारक (Reactant) | ऐसे पदार्थ जिनमें रासायनिक परिवर्तन होता है। इन्हें समीकरण के बाईं ओर (LHS) लिखा जाता है। |
| उत्पाद (Product) | रासायनिक अभिक्रिया के परिणामस्वरूप बनने वाले नए पदार्थ। इन्हें समीकरण के दाईं ओर (RHS) लिखा जाता है। |
| रासायनिक समीकरण (Chemical Equation) | किसी रासायनिक अभिक्रिया को दर्शाने के लिए रासायनिक सूत्रों और प्रतीकों का उपयोग। |
| संतुलित रासायनिक समीकरण (Balanced Chemical Equation) | एक रासायनिक समीकरण जिसमें अभिकारक और उत्पाद दोनों तरफ प्रत्येक तत्व के परमाणुओं की संख्या समान होती है। |
| संयोजन अभिक्रिया (Combination Reaction) | ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं। |
| वियोजन अभिक्रिया (Decomposition Reaction) | ऐसी अभिक्रिया जिसमें एकल अभिकारक टूटकर दो या दो से अधिक छोटे-छोटे उत्पाद प्रदान करता है। |
| ऊष्माक्षेपी अभिक्रिया (Exothermic Reaction) | जिन अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है। |
| ऊष्माशोषी अभिक्रिया (Endothermic Reaction) | जिन अभिक्रियाओं में ऊष्मा का अवशोषण होता है। |
| विस्थापन अभिक्रिया (Displacement Reaction) | जब कोई एक तत्व दूसरे तत्व को उसके यौगिक से विस्थापित कर देता है। |
| द्विविस्थापन अभिक्रिया (Double Displacement Reaction) | वे अभिक्रियाएँ, जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है। |
| अवक्षेपण अभिक्रिया (Precipitation Reaction) | जिस अभिक्रिया में अवक्षेप का निर्माण होता है, यानी एक अघुलनशील पदार्थ बनता है। |
| उपचयन (Oxidation) | जब किसी अभिक्रिया में पदार्थ में ऑक्सीजन की वृद्धि या हाइड्रोजन का ह्रास होता है। |
| अपचयन (Reduction) | जब किसी अभिक्रिया में पदार्थ में ऑक्सीजन का ह्रास या हाइड्रोजन की वृद्धि होती है। |
| रेडॉक्स अभिक्रिया (Redox Reaction) | ऐसी अभिक्रिया जिसमें एक अभिकारक उपचयित होता है तथा दूसरा अभिकारक अपचयित होता है। |
| संक्षारण (Corrosion) | जब कोई धातु अपने आस-पास अम्ल, आर्द्रता आदि के संपर्क में आती है तो वह संक्षारित होती है। इस प्रक्रिया को संक्षारण कहते हैं। |
| विकृतगंधिता (Rancidity) | वसायुक्त अथवा तैलीय खाद्य सामग्री जब उपचयित हो जाती है, तो उनके स्वाद तथा गंध बदल जाते हैं। |
