કાર્બન અને તેનાં સંયોજનો Textbook Questions and Answers
સ્વાધ્યાયના પ્રશ્નોત્તરી
પ્રશ્ન 1. ઇથેન અણુનું આણ્વીય સૂત્ર C2H6 છે, તેમાં …
(a) 6 સહસંયોજક બંધ છે.
(b) 7 સહસંયોજક બંધ છે.
(c) 8 સહસંયોજક બંધ છે.
(d) 9 સહસંયોજક બંધ છે.
પ્રશ્ન 2. બ્યુટેનોન ચાર કાર્બન ધરાવતું સંયોજન છે, જેમાં ક્રિયાશીલ સમૂહ …
(a) કાર્બોક્સિલિક ઍસિડ
(b) આલ્ડિહાઇડ
(c) કીટોન
(d) આલ્કોહોલ
પ્રશ્ન 3. ખોરાક રાંધતી વખતે, જો વાસણનાં તળિયાં બહારથી કાળાં થઈ રહ્યાં હોય, તો તેનો અર્થ એ છે કે …
(a) ખોરાક સંપૂર્ણ રંધાયો નથી.
(b) બળતણનું સંપૂર્ણ દહન થયું નથી.
(c) બળતણ ભીનું છે.
(d) બળતણ સંપૂર્ણ રીતે દહન પામી રહ્યું છે.
પ્રશ્ન 4. CH3Cમાં બંધ-નિર્માણનો ઉપયોગ કરી સહસંયોજક બંધની પ્રકૃતિ સમજાવો.
ઉત્તર: કાર્બન, હાઇડ્રોજન અને ક્લોરિનનો પરમાણ્વીય ક્રમાંક અનુક્રમે 6, 1 અને 17 છે. આથી તેમની ઇલેક્ટ્રૉનીય રચના નીચે મુજબ છે :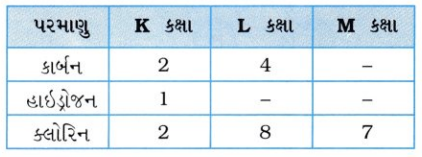
- જે સુચવે છે કે, કાર્બનને અષ્ટક પૂર્ણ કરવા માટે 4 ઇલેક્ટ્રૉનની, હાઇડ્રોજનને ડબ્લેટ duplet) પૂર્ણ કરવા માટે 1 ઇલેક્ટ્રૉનની તથા ક્લોરિનને અષ્ટક પૂર્ણ કરવા માટે 1 ઇલેક્ટ્રૉનની આવશ્યકતા છે.
- આથી કાર્બન પરમાણુની બાહ્યતમ કક્ષાના 4 ઇલેક્ટ્રૉન પૈકી 3 ઇલેક્ટ્રૉન ત્રણ હાઇડ્રોજન પરમાણુના 3 ઇલેક્ટ્રૉન સાથે, જ્યારે 1 ઇલેક્ટ્રૉન ક્લોરિન પરમાણુના 1 ઇલેક્ટ્રૉન સાથે નીચે પ્રમાણે ભાગીદારી કરી ચાર સહસંયોજક બંધ રચે છે :

- આમ, 4 ઇલેક્ટ્રૉન સાથે ભાગીદારી કરી કાર્બન પરમાણુ નજીકના નિષ્ક્રિય વાયુ નિયોન, હાઇડ્રોજન પરમાણુ નજીકના નિષ્ક્રિય વાયુ હિલિયમ અને ક્લોરિન પરમાણુ નજીકના નિષ્ક્રિય વાયુ આર્ગોન જેવી ઇલેક્ટ્રૉનીય રચના પ્રાપ્ત કરી; સ્થિરતા પ્રાપ્ત કરે છે.
- ટૂંકમાં, ક્લોરોમિથેન ત્રણ C – H અને એક C – Cl એમ ચાર સહસંયોજક બંધ રચે છે.
પ્રશ્ન 5. ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ દોરો :
(a) ઇથેનોઇક ઍસિડ
ઉત્તર: ઇથેનોઇક ઍસિડ :

(b) H2S
ઉત્તર: H2S (હાઇડ્રોજન સલ્ફાઇડ) :
(c) પ્રોપેનોન
ઉત્તર: પ્રોપેનોન :

(d) F2
ઉત્તર: F2 (ડાયક્લોરિન) :
પ્રશ્ન 6. સમાનધર્મી શ્રેણી એટલે શું? ઉદાહરણ સહિત સમજાવો.
ઉત્તર: વ્યાખ્યા : કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન-શૃંખલામાં રહેલા હાઇડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
અથવા
સમાન ક્રિયાશીલ સમૂહ ધરાવતાં જે કાર્બનિક સંયોજનોની શ્રેણીનો દરેક સભ્ય તેની પહેલાંના કે પછીના ક્રમિક સભ્યથી કાર્બન અને હાઇડ્રોજન પરમાણુઓની ચોક્કસ સંખ્યા (-CH2)માં તફાવત ધરાવતો હોય, તો તે કાર્બનિક સંયોજનોની શ્રેણીને સમાનધર્મી શ્રેણી કહે છે.
સમજૂતીઃ
CH3 – OH મિથેનોલ
CH3 – CH2 – OH ઇથેનોલ
CH3 – CH2 – CH2 – OH પ્રોપેનોલ
CH3 – CH2 – CH2 – CH2 – OH ![]()
- આ આલ્કોહોલની સમાનધર્મી શ્રેણી છે. આ શ્રેણીના દરેક સભ્યમાં સમાન ક્રિયાશીલ સમૂહ – OH (હાઇડ્રૉક્સિલ) છે.
- આ શ્રેણીમાં ક્રમિક સભ્યથી પહેલાંના કે પછીના સભ્યમાં પરમાણુની સંખ્યામાં – CH2 જેટલો તફાવત છે. તેથી આણ્વીય દળમાં 14 uનો તફાવત છે.
પ્રશ્ન 7. તમે ભૌતિક તેમજ રાસાયણિક ગુણધર્મોને આધારે ઇથેનોલ અને ઇથેનોઇક ઍસિડને કેવી રીતે વિભૂદિત કરશો?
ઉત્તર: ભૌતિક ગુણધર્મોમાં તફાવત :

રાસાયણિક ગુણધર્મોમાં તફાવત :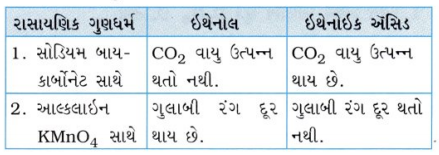
પ્રશ્ન 8. જ્યારે સાબુને પાણીમાં ઉમેરવામાં આવે ત્યારે મિસેલનું નિર્માણ શા માટે થાય છે? શું ઇથેનોલ જેવાં બીજાં દ્રાવકો દ્વારા પણ મિસેલનું નિર્માણ થશે?
ઉત્તર: સાબુનો અણુ જુદા જુદા ગુણધર્મ ધરાવતા બે છેડા ધરાવે છે. એક છેડો ધ્રુવીય શીર્ષ ધરાવે છે, જેને હાઇડ્રોફિલિક શીર્ષ કહે છે. જ્યારે બીજો છેડો અધ્રુવીય પૂંછડી ધરાવે છે, જેને હાઇડ્રોફોબિક પૂંછડી કહે છે.
- ધ્રુવીય શીર્ષ પાણીના અણુ પ્રત્યે આકર્ષણ ધરાવે છે, જ્યારે અધ્રુવીય પૂંછડી પાણીના અણુ પ્રત્યે અપાકર્ષણ ધરાવે છે.
- જ્યારે સાબુને પાણીમાં ઓગાળવામાં આવે છે ત્યારે,
ધ્રુવીય શીર્ષ પાણીમાં દ્રાવ્ય થાય છે, પરંતુ અધુવીય પૂંછડી પાણીમાં અદ્રાવ્ય રહે છે. પરિણામે ગોળાકાર મિસેલ રચાય છે.

- સાબુ ઇથેનોલમાં સંપૂર્ણ દ્રાવ્ય છે. આથી ઇથેનોલ જેવાં દ્રાવકોમાં મિસેલ રચના શક્ય નથી.
પ્રશ્ન 9. કાર્બન અને તેનાં સંયોજનોનો ઉપયોગ મોટે ભાગે બળતણ તરીકે શા માટે થાય છે?
ઉત્તર: જ્યારે કાર્બનનું હવા અથવા ઑક્સિજનની હાજરીમાં દહન કરવામાં આવે ત્યારે કાર્બન ડાયૉક્સાઇડ અને પાણી ઉત્પન્ન થાય છે. ઉપરાંત વિપુલ પ્રમાણમાં ઊર્જા અને પ્રકાશ ઉત્પન્ન થાય છે.
C(s) + O2(g) → CO2(g) + ઊર્જા + પ્રકાશ
- જ્યારે કાર્બન અને તેના સંયોજનનું દહન કરવામાં આવે ત્યારે વધારાની ઉષ્માની જરૂર પડતી નથી. તેથી કાર્બન અને તેનાં સંયોજનો બળતણ માટે ઉપયોગી છે.
પ્રશ્ન 10. કઠિન પાણીમાં સાબુનો ઉપયોગ કરવાથી થતું ફીણનું નિર્માણ સમજાવો.
ઉત્તર: કઠિન પાણી કેલ્શિયમ અને મૅગ્નેશિયમ આયનો ધરાવે છે, જે સાબુના અણુ સાથે સંયોજાઈ કૅલ્શિયમ અને મૅગ્નેશિયમના સફેદ અવક્ષેપ બનાવે છે, જેને સ્કમ (Scum) કહે છે.

પ્રશ્ન 11. જો તમે લિટમસપેપર(લાલ અથવા ભૂરા)થી સાબુને ચકાસો, તો તમે શું ફેરફાર અવલોકિત કરશો?
ઉત્તર: સાબુ એ બેઝિક (આલ્કલાઇન) માધ્યમ ધરાવતો હોઈ, લાલ લિટમસપત્ર ભૂરું (વાદળી) બને છે, જ્યારે વાદળી લિટમસપત્ર પર કોઈ અસર થશે નહિ.
પ્રશ્ન 12. હાઇડ્રોજનીકરણ એટલે શું? તેની ઔદ્યોગિક ઉપયોગિતા શું છે?
ઉત્તર: અસંતૃપ્ત હાઇડ્રોકાર્બન સંયોજનની નિકલ અથવા પેલેડિયમ ઉદ્દીપકની હાજરીમાં ડાયહાઇડ્રોજન સાથે પ્રક્રિયા થઈ સંતૃપ્ત હાઇડ્રોકાર્બન બનવાની ક્રિયાને હાઇડ્રોજનીકરણ કહે છે. ઉપયોગઃ હાઇડ્રોજીનેશનથી ઔદ્યોગિક ધોરણે વનસ્પતિ તેલમાંથી વનસ્પતિ ઘી બનાવી શકાય છે.

પ્રશ્ન 13. આપેલ હાઇડ્રોકાર્બન C2H6, C3H8, C3H6, C2H2 અને CH4 પૈકી કોની યોગશીલ પ્રક્રિયા થાય છે?
ઉત્તર: C3H6 અને C2H2 આ બંને સંયોજનો અસંતૃપ્ત હોવાથી તેમની યોગશીલ પ્રક્રિયા થાય છે.

પ્રશ્ન 14. સંતૃપ્ત અને અસંતૃપ્ત હાઇડ્રોકાર્બનને વિદિત કરવા ઉપયોગમાં લેવાતી એક કસોટી જણાવો.
ઉત્તર: માખણ સંતૃપ્ત હાઇડ્રોકાર્બન સંયોજન છે, જ્યારે રાંધવા માટે વપરાતું તેલ અસંતૃપ્ત હાઇડ્રોકાર્બન સંયોજન છે.
- અસંતૃપ્ત સંયોજન આલ્કલાઇન KMnO4નો ગુલાબી રંગ દૂર કરે છે.
- માખણમાં થોડા પ્રમાણમાં આલ્કલાઇન KMnO4 ઉમેરવાથી તેનો ગુલાબી રંગ દૂર થતો નથી, જ્યારે રાંધવા માટે વપરાતા તેલમાં થોડા પ્રમાણમાં આલ્કલાઇન KMnO4 ઉમેરતાં તેનો ગુલાબી રંગ દૂર થાય છે.
પ્રશ્ન 15. સાબુની સફાઈ પ્રક્રિયાની ક્રિયાવિધિ સમજાવો.
ઉત્તર: જુઓ ‘પ્રશ્નોત્તર વિભાગના પ્રશ્ન 65નો ઉત્તર.
કાર્બન અને તેનાં સંયોજનો Intext Questions and Answers
(Intext પ્રજ્ઞોત્તર [ પા.પુ. પાના નં. 61)
પ્રશ્ન 1. CO2 સૂત્ર ધરાવતા કાર્બન ડાયૉક્સાઇડનું ઇલેક્ટ્રૉનબિંદુ નિરૂપણ શું થશે?
ઉત્તર: કાર્બન અને ઑક્સિજનની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :

પ્રશ્ન 2. સલ્ફરના આઠ પરમાણુઓથી બનેલ સલ્ફર અણુનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ શું થશે? (સૂચનઃ સલ્ફરના આઠ પરમાણુઓ એકબીજા સાથે જોડાઈને ચક્ર બનાવે છે.)
ઉત્તર: 16s ની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :
- S8 અણુનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :

Intext પ્રશ્નોત્તર (પા.પુ. પાના નં. 68 – 69)
પ્રશ્ન 1. પેન્ટેન માટે તમે કેટલા બંધારણીય સમઘટકો દોરી શકો?
ઉત્તર:

પ્રશ્ન 2. કાર્બનના બે ગુણધર્મો કયા છે, જેના કારણે આપણી ચારેય તરફ કાર્બન સંયોજનોની વિશાળ સંખ્યા આપણે જોઈએ છીએ?
ઉત્તર: કાર્બન પરમાણુ અન્ય પરમાણુઓ સાથે ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા સહસંયોજક બંધનું નિર્માણ કરી, અનેક સંયોજનો બનાવે છે; જે સંખ્યા આશરે ત્રણ મિલિયન જેટલી અંદાજવામાં આવી છે.
- કાર્બન વધુ સંખ્યામાં સંયોજનો બનાવવાની ક્ષમતા ધરાવે છે, જે નીચેનાં પરિબળો પર આધાર રાખે છે :
(1) કાર્બનનો કેટેનેશન ગુણઃ કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ સાથે બંધ બનાવવાની અદ્વિતીય ક્ષમતા ધરાવતો હોવાથી ખૂબ જ વધુ સંખ્યામાં અણુઓ (સંયોજનો) બને છે. કાર્બનના આ ગુણધર્મને કેટેનેશન કહે છે.
- આ સંયોજનો કાર્બનની લાંબી શૃંખલા, કાર્બનની શાખિત શૃંખલા અથવા વલયોમાં ગોઠવાયેલા કાર્બન પરમાણુઓ ધરાવે છે.

- કાર્બન પરમાણુ એકલબંધ અથવા તિબંધ અથવા ત્રિબંધ દ્વારા પણ અન્ય પરમાણુઓ સાથે જોડાઈ શકે છે.
- જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એકલબંધથી, જોડાયેલા હોય તેવાં કાર્બનનાં સંયોજનોને સંતૃપ્ત સંયોજનો (Saturated Compounds) કહે છે.
- જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ દ્વિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં કાર્બનનાં સંયોજનોને અસંતૃપ્ત સંયોજનો (Unsaturated Compounds) કહે છે.
- કાર્બન સંયોજનોમાં જે હદે કેટેનેશનનો ગુણધર્મ જોવા મળે છે, તે કોઈ બીજા તત્ત્વમાં જોવા મળતો નથી. સિલિકોન હાઇડ્રોજન સાથે જે સંયોજનો બનાવે છે, તેમાં સાત અથવા આઠ પરમાણુઓ સુધીની જ શૃંખલા હોય છે. પરંતુ આ સંયોજનો અતિ ક્રિયાશીલ હોય છે.
- કાર્બન-કાર્બન બંધ ખૂબ જ પ્રબળ હોવાથી કાર્બન પરમાણુઓના એકબીજા સાથે જોડાણથી મોટી સંખ્યામાં સ્થાયી સંયોજનો બને છે.
(2) કાર્બનની સંયોજકતાઃ કાર્બનની સંયોજકતા ચાર છે. તેથી તે કાર્બનના અન્ય ચાર પરમાણુઓ અથવા કેટલાક અન્ય એક-સંયોજક તત્ત્વોના પરમાણુઓ સાથે બંધ બનાવવાની ક્ષમતા ધરાવે છે.
- કાર્બન એ ઑક્સિજન, હાઈડ્રોજન, નાઇટ્રોજન, સલ્ફર, ક્લોરિન તથા અનેક અન્ય તત્ત્વો સાથે વિશિષ્ટ ગુણધર્મોવાળાં સંયોજનો બનાવે છે. આ વિશિષ્ટ ગુણધર્મો સંયોજનમાં હાજર રહેલા કાર્બન સિવાયના તત્ત્વ પર પણ આધાર રાખે છે.
- કાર્બન પરમાણુ મોટા ભાગનાં અન્ય તત્ત્વો સાથે ખૂબ જ પ્રબળ બંધ બનાવે છે, જે સંયોજનોને અપવાદ રૂપે સ્થાયી બનાવે છે.
- કાર્બનનું કદ નાનું હોવાથી પરમાણુ કેન્દ્ર દ્વારા ભાગીદારી પામેલા ઇલેક્ટ્રૉન-યુઓને મજબૂતાઈથી જકડી રાખે છે. આથી કાર્બન દ્વારા પ્રબળ બંધોનું નિર્માણ થાય છે. મોટા પરમાણુઓ ધરાવતાં તત્ત્વો દ્વારા બનતા બંધ અત્યંત નિર્બળ હોય છે.
પ્રશ્ન 3. સાયક્લોપેન્ટેનનું સૂત્ર અને ઇલેક્ટ્રૉન-બિંદુ રચના શું થશે?
ઉત્તર: સાયક્લોઆલ્કનનું સામાન્ય સૂત્ર CnH2n છે. આથી સાયક્લોપેન્ટેનનું આવીય સૂત્ર C5H10 છે.
- સાયક્લોપેન્ટેનનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :

પ્રશ્ન 4. નીચે દર્શાવેલ સંયોજનોનાં બંધારણ દોરો :
(i) ઇથેનોઇક ઍસિડ
(ii) બ્રોમોપેન્ટન
(iii) બ્યુટેનોન
(iv) હેઝેનાલ
શું બ્રોમોપેન્ટેનના બંધારણીય સમઘટક શક્ય છે?
ઉત્તર:


પ્રશ્ન 5. નીચે દર્શાવેલ સંયોજનોનું નામ તમે કેવી રીતે આપશો?
(i) CH3 – CH2 – Br
(ii)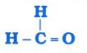
(iii)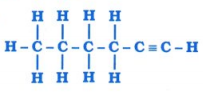
ઉત્તર: ઉપરોક્ત સંયોજનોનાં નામ નીચે મુજબ છે :
(i) બ્રોમાઇથેન
(ii) મિથેનાલ
(iii) હેક્ઝ-1-આઇન અથવા હેક્ઝાઇન
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં 71]
પ્રશ્ન 1. ઇથેનોલનું ઇથેનોઇક ઍસિડમાં રૂપાંતર એ શા માટે ઑક્સિડેશન પ્રક્રિયા છે?
ઉત્તર: ઇથેનોલનું ઇથેનોઇક ઍસિડમાં રૂપાંતર નીચેના સમીકરણ દ્વારા દર્શાવી શકાય છેઃ

- આ પ્રક્રિયામાં પ્રક્રિયક ઇથેનોલ એક ઑક્સિજન પરમાણુ ધરાવે છે. જ્યારે નીપજ ઇથેનોઇક ઍસિડ બે ઑક્સિજન પરમાણુ ધરાવે છે. આમ, આ પ્રક્રિયા દરમિયાન ઑક્સિજન પરમાણુ ઉમેરાય છે. આથી આ રૂપાંતર ઑક્સિડેશન પ્રક્રિયા છે.
પ્રશ્ન 2. ઑક્સિજન અને ઇથાઇનનું મિશ્રણ વેલ્ડિંગ માટે સળગાવવામાં આવે છે. શું તમે કહી શકો કે શા માટે ઇથાઇન અને હવાના મિશ્રણનો ઉપયોગ થતો નથી?
ઉત્તર: ઇથાઇન એ અસંતૃપ્ત હાઇડ્રોકાર્બને છે.
- જ્યારે તેનું હવાના મિશ્રણ સાથે દહન કરવામાં આવે ત્યારે ખૂબ જ છે કાળા ધુમાડાવાળી પીળી જ્યોત આપે છે.
- આ અપૂર્ણ દહન થવાથી ખૂબ જ ઓછી ઉષ્મા મુક્ત થાય છે, જે વેલ્ડિંગ માટે જરૂરી ઊર્જા કરતાં ઓછી છે. આથી ઇથાઇન અને હવાના મિશ્રણનો ઉપયોગ વેલ્ડિંગ માટે થતો નથી.
- જ્યારે ઇથાઇનનું ઑક્સિજન સાથે દહન કરવામાં આવે ત્યારે સંપૂર્ણ દહન થવાથી ખૂબ જ વધુ ઉષ્મા મુક્ત થાય છે, જે વેલ્ડિંગ માટે જરૂરી ઉષ્મા જેટલી હોય છે. આથી ઇથાઇન અને ઑક્સિજનનું મિશ્રણ વેલ્ડિંગ માટે ઉપયોગી છે.
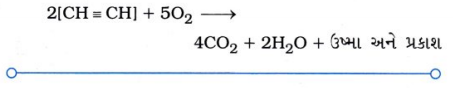
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 74]
પ્રશ્ન 1. પ્રાયોગિક ધોરણે તમે આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડને કેવી રીતે જુદા પાડશો?
ઉત્તર: આલ્કોહોલ અને કાબૉક્સિલિક ઍસિડ પ્રાયોગિક રીતે નીચેની પ્રક્રિયા દ્વારા અલગ કરી શકાય છે:
- સોડિયમ હાઇડ્રોજન કાર્બોનેટ કસોટી : બે જુદી જુદી કસનળીમાં બંને પદાર્થોનો થોડો જથ્થો લઈ, તેમાં સોડિયમ હાઇડ્રોજન કાર્બોનેટનું દ્રાવણ ઉમેરવામાં આવે છે.
- જે કસનળીમાં કાર્બોક્સિલિક ઍસિડનું દ્રાવણ હશે તે કસનળીમાં ઝડપથી CO2 વાયુના ઊભરા આવે છે, જ્યારે ઇથેનોલના દ્રાવણમાં CO2 વાયુના ઊભરા આવતા નથી.
- આલ્કલાઇન પોટેશિયમ પરમેંગેનેટ કસોટી : બે જુદી જુદી કસનળીમાં બંને પદાર્થોનો થોડો જથ્થો લઈ, તેમાં આલ્કલાઇન પોટેશિયમ પરમેંગેનેટનું દ્રાવણ ઉમેરવામાં આવે છે.
- જે કસનળીમાં આલ્કોહોલનું દ્રાવણ હશે તે કસનળીમાં પોટેશિયમ પરમેંગેનેટનો જાંબલી રંગ દૂર થાય છે, જ્યારે કાબૉક્સિલિક ઍસિડનું દ્રાવણ પોટેશિયમ પરમેંગેનેટનો રંગ દૂર કરતું નથી.
પ્રશ્ન 2. ઑક્સિડેશનકર્તા એટલે શું?
ઉત્તર: ઑક્સિડેશનઃ પદાર્થમાં ઑક્સિજન ઉમેરાવાની ક્રિયાને ઑક્સિડેશન કહે છે.
ઑક્સિડેશનકર્તા: જે પદાર્થો અન્ય પદાર્થોમાં ઑક્સિજન ઉમેરવા માટે સક્ષમ હોય તેને ઑક્સિડેશનકર્તા કહે છે.
દા. ત., આલ્કલાઇન પોટેશિયમ પરમેંગેનેટ (KMnO4), ઍસિડિક પોટેશિયમ ડાયક્રોમેટ (K2Cr2O7)
Intext પ્રશ્નોત્તર [ પા.પુ. પાના નં. 76]
પ્રશ્ન 1. શું તમે પ્રક્ષાલકનો ઉપયોગ કરી ચકાસી શકો છો કે પાણી કઠિન છે કે નહિ?
ઉત્તર: ના. કારણ કે પ્રક્ષાલક કઠિન અને નરમ એમ બંને પ્રકારના પાણીમાં ફીણ ઉત્પન્ન કરે છે.
પ્રશ્ન 2. લોકો કપડાં ધોવા માટે વિવિધ પદ્ધતિઓનો ઉપયોગ કરે છે. સામાન્ય રીતે સાબુ ઉમેર્યા પછી લોકો કપડાં પથ્થર પર પછાડે છે કે પાવડી સાથે પછાડે છે. બ્રશથી ઘસે છે અથવા મિશ્રણને વૉશિંગ મશીનમાં ક્ષોભિત કરે (ખૂબ જોરથી હલાવે) છે. સાફ કપડાં મેળવવા માટે તેને રગડવાની જરૂર શા માટે પડે છે?
ઉત્તર: સાબુ પાણીનું પૃષ્ઠતાણ ઘટાડે છે.
- સાબુનો અધ્રુવીય પૂંછડીવાળો હાઇડ્રોકાર્બન ભાગ એ કપડાં પરના મેલ અથવા તેલના અણુ સાથે આકર્ષાય છે, જ્યારે ધ્રુવીય પૂંછડીવાળો ભાગ એ પાણી પ્રત્યે આકર્ષાય છે. તેથી મિસેલની રચના થાય છે.
- આ મિસેલ કપડાં પરથી દૂર કરવા માટે રગડવાની જરૂર પડે છે.
કાર્બન અને તેનાં સંયોજનો Textbook Activities
પ્રવૃત્તિ 4.1 [પા.પુ. પાના નં. 58]
• હેતુ: રોજિંદા જીવનમાં વપરાતી વસ્તુઓ કાર્બનની બનેલી હોય છે. જે
પ્રશ્નો : સવારથી તમે જે વસ્તુઓનો ઉપયોગ કરો છો અથવા વાપરો છો, તે પૈકી દસ વસ્તુઓની યાદી બનાવો.
- આ યાદીને તમારા સહાધ્યાયીએ બનાવેલ યાદી સાથે સરખાવો તેમજ વસ્તુઓને નીચે દર્શાવેલ કોષ્ટકમાં વર્ગીકૃત કરો.
- જો વસ્તુઓ એક કરતાં વધુ સામગ્રીની બનેલી હોય, તો તેઓને બંને સંબંધિત ખાનાઓમાં મૂકો.
ઉત્તર: સવારથી જ ઉપયોગમાં આવતી વસ્તુઓની યાદી નીચે મુજબ છે :
ટૂથબ્રશ, ટૂથપેસ્ટ, ડોલ, પાણી, સાબુ, ડિટર્જન્ટ, રસોઈનાં વાસણો, કપ, દૂધ, દવા, વર્તમાનપત્ર, પુસ્તકો.
પ્રવૃત્તિ 4.2 [પા.પુ. પાના નં. 67]
• હેતુ: સમાનધર્મી શ્રેણીનો ખ્યાલ સમજાવો.
પ્રશ્નો:
પ્રશ્ન 1.
(a) CH3OH ![]() C2H5OH
C2H5OH
(b) C2H5OH ![]() C3H7OH
C3H7OH ![]()
(c) C3H7OH ![]() દળના તફાવતની ગણતરી કરો.
દળના તફાવતની ગણતરી કરો.
ઉત્તર:

પ્રશ્ન 2. આ ત્રણેય વચ્ચે કોઈ સમાનતા છે?
ઉત્તર: આ ત્રણેય વચ્ચે નીચે મુજબની સમાનતા છે :
- આ ત્રણેયના આણ્વીય સૂત્ર વચ્ચેનો તફાવત CH2 છે.
- આ ત્રણેયના આવીય દળ વચ્ચેનો તફાવત 14 u છે.
- આ ત્રણેયના નામકરણમાં સમાન પ્રત્યય ‘ઓલ’ લાગે છે.
- આ ત્રણેયને કોઈ એક સામાન્ય સૂત્ર CnH2n+1OH વડે દર્શાવી શકાય છે.
- આ ત્રણેયની રાસાયણિક પ્રક્રિયાઓ સમાન છે.
- આ ત્રણેય આલ્કોહોલ સંયોજનો છે.
પ્રશ્ન 3. એક પરિવાર તૈયાર કરવા માટે આ આલ્કોહોલને કાર્બન પરમાણુઓના ચડતા ક્રમમાં ગોઠવો. શું આ પરિવારને સમાનધર્મી શ્રેણી કહી શકાય?
ઉત્તર: કાર્બન પરમાણુઓના ચડતા ક્રમમાં આલ્કોહોલ નીચે મુજબ છે :
CH3OH, C2H5OH, C3H7OH, C4H9OH
- હા, આ પરિવારને સમાનધર્મી શ્રેણી કહી શકાય.
પ્રશ્ન 4. પ્રશ્ન 30માં આપેલ અન્ય ક્રિયાશીલ સમૂહો માટે ચાર કાર્બન સુધીનાં સંયોજનોની સમાનધર્મી શ્રેણી તૈયાર કરો.
ઉત્તર: હેલોજન સમૂહ માટેની સમાનધર્મી શ્રેણી [CnH2n+1X].
CH3Cl, C2H5Cl, C3H7Cl, C4H9Cl
- આલ્ડિહાઇડ સમૂહ માટેની સમાનધર્મી શ્રેણી : [CnH2nO].
HCHO, CH3CHO, CH3CH2CHO, CH3CH2CH2CHO - કીટોન સમૂહ માટેની સમાનધર્મી શ્રેણી [CnH2nO]
CH3COCH3, CH3COC2H5, CH3COC3H7, CH3COC4H9 - કાર્બોક્સિલિક ઍસિડ સમૂહ માટેની સમાનધર્મી શ્રેણી [CnH2nO2)
HCOOH, CH3COOH, CH3CH2COOH, CH3CH2CH2COOH
પ્રવૃત્તિ 4.3 (પા.પુ. પાના નં. 69)
• હેતુઃ કાર્બન સંયોજનોના દહન દ્વારા ઉત્પન્ન થતી જ્યોતનો અભ્યાસ કરવો.
ચેતવણી: પ્રવૃત્તિમાં શિક્ષકની મદદ જરૂરી છે.
પ્રવૃત્તિ :
- અમુક કાર્બન સંયોજનો(નંથેલીન, કપૂર, આલ્કોહોલ)ને વારાફરતી એક ચમચી પર લઈ, તેમને સળગાવો.
- જ્યોતના પ્રકારનું અવલોકન કરો અને ધુમાડો ઉત્પન્ન થયો કે નહિ તે નોંધો.
- જ્યોતની ઉપર ધાતુની તકતી રાખો. શું તકતી પર સંયોજનો પૈકી કાંઈ પદાર્થ જમા થાય છે?
અવલોકન કપૂર અને આલ્કોહોલ એ શુદ્ધ તેજસ્વી ભૂરી જ્યોત સાથે સળગે છે તથા તકતી પર કોઈ જ પદાર્થ જમા થતો નથી. - નૈથેલીન એ કાળા ધુમાડાવાળી પીળી જ્યોત સાથે સળગે છે તથા તકતી પર કાળો અવશેષ (મેલ) જમા થાય છે.
નિર્ણય કપૂર અને આલ્કોહોલ સંતૃપ્ત હાઇડ્રોકાર્બન છે, જ્યારે ગૂંથેલીન એ અસંતૃપ્ત હાઇડ્રોકાર્બન છે.
પ્રવૃત્તિ 4.4 (પા.પુ. પાના નં. 69)
• હેતુઃ સંપૂર્ણ અને અપૂર્ણ દહન દ્વારા ઉદ્ભવતી જ્યોતનો અભ્યાસ કરવો.
પ્રવૃત્તિઃ
એક બન્સન બર્નર ચાલુ કરો અને જુદા જુદા પ્રકારની જ્યોત | ધુમાડાની હાજરી પ્રાપ્ત કરવા માટે તેના તળિયાનું હવાછિદ્ર વ્યવસ્થિત કરો.
પ્રશ્નો :
પ્રશ્ન 1. તમે પીળી જ્યોત ક્યારે મેળવો છો?
ઉત્તર: જ્યારે બન્સન બર્નરનાં બધાં હવાછિદ્રો ખુલ્લાં ના હોય ત્યારે હવાનો પુરવઠો સીમિત થતાં, હાઇડ્રોકાર્બનનું અપૂર્ણ દહન થતાં પીળી જ્યોત મળે છે.
પ્રશ્ન 2. તમે ભૂરી જ્યોત ક્યારે મેળવો છો?
ઉત્તર: જ્યારે બન્સન બર્નરનાં બધાં જ હવાછિદ્રો ખુલ્લાં હોય ત્યારે પૂરતી માત્રામાં ઑક્સિજનયુક્ત મિશ્રણ દહન પામી ધુમાડા રહિત ભૂરી જ્યોત મળે છે.
પ્રવૃત્તિ 4.5 [પા.પુ. પાના નં. 70].
• હેતુઃ આલ્કોહોલનું આલ્કલાઇન KMnO4 વડે થતું ઑક્સિડેશન સમજવું.
પ્રવૃત્તિ:
- એક કસનળીમાં આશરે 3mL ઇથેનોલ લઈ, તેને જળ ઉખક| (water Bath)માં ધીમે ધીમે હુંફાળું ગરમ કરો.
- આ દ્રાવણમાં આલ્કલાઇન પોટૅશિયમ પરમેંગેનેટનું 5 % દ્રાવણ ટીપે ટીપે ઉમેરો.
પ્રશ્નો :
પ્રશ્ન 1. જ્યારે શરૂઆતમાં પોટૅશિયમ પરમેંગેનેટ ઉમેરવામાં આવે ત્યારે શું તેનો રંગ તેનો તે જ રહે છે?
ઉત્તર: શરૂઆતમાં KMnO4 ઉમેરવામાં આવે ત્યારે તેનો રંગ દૂર થાય છે, કારણ કે KMnO4, એ ઑક્સિડેશનકર્તા પદાર્થ હોવાથી ઇથેનોલનું ઇથેનોઇક ઍસિડમાં ઑક્સિડેશન કરે છે અને તેનું રિડક્શન થઈ MnO2 બને છે.
[નોંધ : આ પ્રક્રિયાને બેયર કસોટી કહે છે.
પ્રશ્ન 2.
વધુ માત્રામાં પોટેશિયમ પરમેંગેનેટ ઉમેરવામાં આવે ત્યારે તેનો રંગ શા માટે દૂર થતો નથી?
ઉત્તર:
વધુ માત્રામાં KMnO4 ઉમેરવાથી વધારાનો KMnO4 પ્રક્રિયામાં વપરાયા વગરનો બાકી રહે છે. તેથી KMnO4નો રંગ દૂર થતો નથી.
પ્રવૃત્તિ 4.6 [પા.પુ. પાના નં. 72]
• હેતુ ઇથેનોલની સોડિયમ ધાતુ સાથેની પ્રક્રિયાથી ઉદ્ભવતા હાઇડ્રોજન વાયુનો અભ્યાસ કરવો.
પ્રવૃત્તિ:
શિક્ષક દ્વારા નિદર્શન
ઇથેનોલ(નિરપેક્ષ આલ્કોહોલ)માં ભાતના બે દાણાના કદ જેટલો સોડિયમ ધાતુનો નાનો ટુકડો નાખો.
પ્રશ્નો :
પ્રશ્ન 1. તમે શું અવલોકન કરો છો?
ઉત્તર: ઇથેનોલની સોડિયમ ધાતુ સાથે પ્રક્રિયા થવાથી હાઇડ્રોજન વાયુ ઉત્પન્ન થાય છે.
પ્રશ્ન 2. તમે ઉભવતા વાયુને કેવી રીતે ચકાસશો?
ઉત્તર: ઉદ્ભવતા હાઈડ્રોજન વાયુની નજીક સળગતી દીવાસળી લઈ જતાં વાયુ પોપ અવાજથી સળગે છે.
પ્રવૃત્તિ 4.7 [પા.પુ. પાના નં 73]
• હેતુ : મંદ ઍસિટિક ઍસિડ અને મંદ હાઇડ્રોક્લોરિક ઍસિડની પ્રબળતા સમજવી.
પ્રવૃત્તિઃ
લિટમસપત્ર અને સાર્વત્રિક સૂચકનો ઉપયોગ કરી, મંદ ઍસિટિક ઍસિડ અને મંદ હાઇડ્રોક્લોરિક ઍસિડ બંનેની pHની સરખામણી કરો.
પ્રશ્નો :
પ્રશ્ન 1. શું લિટમસ કસોટી દ્વારા બંને ઍસિડ સૂચિત થાય છે?
ઉત્તર: બંને ઍસિડ ભૂરા લિટમસપત્રને લાલ બનાવે છે, અર્થાત્ બંને ઍસિડ લિટમસ કસોટી દ્વારા સૂચિત થાય છે.
પ્રશ્ન 2. શું સાર્વત્રિક સૂચક તેમને એકસમાન પ્રબળતા ધરાવતા ઍસિડ દર્શાવે છે?
ઉત્તર: સાર્વત્રિક સૂચક દ્વારા બંને ઍસિડના pH મૂલ્ય ભિન્ન મળે છે. મંદ ઍસિટિક ઍસિડના દ્રાવણની pH મૂલ્ય 4 છે, જ્યારે મંદ HCના દ્રાવણની pH મૂલ્ય 2 છે; જે સૂચવે છે કે ઍસિટિક ઍસિડ એ હાઇડ્રૉક્લોરિક ઍસિડ કરતાં નિર્બળ ઍસિડ છે.
પ્રવૃત્તિ 4.8 [પા.પુ. પાના નં. 73]
• હેતુઃ એસ્ટરની બનાવટ અને ગુણધર્મનો અભ્યાસ કરવો.
પ્રવૃત્તિ :

- એક કસનળીમાં 1 mL ઇથેનોલ (પરિશુદ્ધ આલ્કોહોલ) અને 1 mL ગ્લેસિયલ ઍસિટિક ઍસિડ અને સાથે સાથે સાંદ્ર H2SO4 નાં થોડાં ટીપાં ઉમેરો.
- આકૃતિ 4.4માં દર્શાવ્યા પ્રમાણે તેને ઓછામાં ઓછી પાંચ મિનિટ સુધી પાણી ઉષ્મકમાં હુંફાળું ગરમ કરો.
- હવે તેને 20 -50 mL પાણી ધરાવતા બીકરમાં ઉમેરો અને તે મિશ્રણને સૂંઘો.
- નિરપેક્ષ આલ્કોહોલ અને ગ્લેસિયલ ઍસિટિક ઍસિડમાં સાંદ્ર સક્યુરિક ઍસિડનાં થોડાં ટીપાં ઉમેરી, ગરમ કરતાં મીઠી સુગંધ ધરાવતું એસ્ટર સંયોજન બને છે.
પ્રવૃત્તિ 4.9 [પા.પુ. પાના નં. 74]
• હેતુ: કાબૉક્સિલિક ઍસિડની Na2CO3 અને NaHCO3 સાથેની ? પ્રક્રિયા સમજવી.
પ્રવૃત્તિઃ
- પ્રકરણ 2, પ્રવૃત્તિ 2.5માં દર્શાવ્યા પ્રમાણે સાધનોની ગોઠવણ કરો.
- એક કસનળીમાં એક સ્પેગ્યુલા ભરીને સોડિયમ કાર્બોનેટ લો અને તેમાં 2 mL મંદ ઇથેનોઇક ઍસિડ ઉમેરો.
પ્રશ્નો :
પ્રશ્ન 1. તમે શું અવલોકન કરો છો?
ઉત્તર: જ્યારે સોડિયમ કાર્બોનેટમાં 2 mL મંદ ઇથેનોઇક ઍસિડ ઉમેરવામાં આવે ત્યારે ઝડપથી ઊભરા સાથે કાર્બન ડાયૉક્સાઇડ વાયુ મુક્ત થાય છે.
પ્રશ્ન 2. ઉદ્ભવતા વાયુને તાજા બનાવેલા ચૂનાના પાણીમાં પસાર કરો. તમે શું અવલોકન કરો છો?
ઉત્તર: ઉદ્ભવતા વાયુને તાજા બનાવેલા ચૂનાના પાણીમાં પસાર કરતાં દ્રાવણ દૂધિયું બને છે, કારણ કે અદ્રાવ્ય કૅલ્શિયમ હાઇડ્રૉક્સાઇડ બને છે.
પ્રશ્ન ૩. શું ઇથેનોઇક ઍસિડ અને સોડિયમ કાર્બોનેટ વચ્ચેની પ્રક્રિયાથી ઉદ્ભવતા વાયુની ઓળખ આ કસોટીથી થઈ શકે છે?
ઉત્તર: હા, આ કસોટી દ્વારા CO2 ની ઓળખ થઈ શકે છે.
- સોડિયમ કાર્બોનેટના બદલે સોડિયમ હાઇડ્રોજન કાર્બોનેટ લઈ આ પ્રવૃત્તિ ફરીથી કરો.
પ્રવૃત્તિ 4.10 [પા.પુ. પાના નં. 74]
• હેતુ: સાબુના દ્રાવણમાં તેલની દ્રાવ્યતા તપાસવી.
પ્રવૃત્તિ :
- બે કસનળી લઈ, દરેકમાં 10 – 10 mL પાણી લો.
- બંને કસનળીમાં એક ટીપું તેલ (ખાદ્ય તેલ) ઉમેરો અને તેને “A’ અને ‘B’ નામ આપો.
- કસનળી ‘B’માં સાબુના દ્રાવણનાં થોડાં ટીપાં ઉમેરો.
- હવે બંને કસનળીને એકસમાન સમય માટે વધુ હલાવો.
પ્રશ્નો :
પ્રશ્ન 1. શું તમે કસનળીઓને હલાવવાનું બંધ કર્યા પછી તરત જ તેમાં તેલ અને પાણીના સ્તરને અલગ જોઈ શકો છો?
ઉત્તર: કસનળી “A’માં બંને સ્તર અલગ જોઈ શકાય છે. જ્યારે કસનળી ‘B’માં અલગ સ્તર જોઈ શકાતું નથી.
પ્રશ્ન 2. થોડા સમય માટે બંને કસનળીને ખલેલ પહોંચાડ્યા વગર રાખી મૂકો અને અવલોકન કરો. શું તેલનું સ્તર અલગ થાય છે? આવું પ્રથમ કઈ કસનળીમાં થાય છે?
ઉત્તર: કસનળી માં અલગ સ્તર રચાય છે. જ્યારે કસનળી “B’માં અલગ સ્તર રચાતું નથી.
પ્રવૃત્તિ 4.11 [પા.પુ. પાના નં. 76]
• હેતુઃ સાબુની નરમ અને કઠિન પાણી સાથેની પ્રક્રિયા તપાસવી.
પ્રવૃત્તિ:
- એક કસનળીમાં 10 mL નિયંદિત પાણી (વરસાદનું પાણી) અને બીજી કસનળીમાં 10 mL કઠિન પાણી (કૂવાનું અથવા હેન્ડપંપનું પાણી) લો.
- બંનેમાં સાબુના દ્રાવણનાં થોડાં ટીપાં ઉમેરો.
- બંને કસનળીને એકસમાન સમય માટે જોશપૂર્વક હલાવો અને ઉદ્ભવતા ફીણની માત્રાનું અવલોકન કરો.
પ્રશ્નો :
પ્રશ્ન 1. તમને કઈ કસનળીમાં ફીણ મળે છે?
ઉત્તર: જે કસનળી નરમ પાણી, અર્થાત્ નિયંદિત પાણી (વરસાદનું પાણી) ધરાવે છે, તેમાં ઝડપથી ફીણ ઉત્પન્ન થાય છે.
પ્રશ્ન 2. કઈ કસનળીમાં દહીં જેવા સફેદ અવક્ષેપ મળે છે?
[શિક્ષક માટે નોંધ : જો તમારી આસપાસ કઠિન પાણી ઉપલબ્ધ ન હોય, તો પાણીમાં હાઇડ્રોજન કાર્બોનેટ | સલ્ફટ | મૅગ્નેશિયમ કે કૅલ્શિયમ ક્લોરાઇડ ઓગાળીને કઠિન પાણી તૈયાર કરો]
ઉત્તર: જે કસનળી કઠિન પાણી, અર્થાત્ કૂવાનું પાણી ધરાવે છે, તેમાં દહીં જેવા સફેદ અવક્ષેપ મળે છે.
પ્રવૃત્તિ 4.12 [પા.પુ. પાના નં. 76]
• હેતુઃ કઠિન પાણીની સાબુ અને ડિટર્જન્ટ સાથેની દ્રવ્યતા તપાસવી.
પ્રવૃત્તિ:
- બે કસનળી લઈ, તે દરેકમાં 10 mL કઠિન પાણી લો.
- એકમાં સાબુના દ્રાવણનાં પાંચ ટીપાં અને બીજામાં પ્રક્ષાલકના દ્રાવણનાં પાંચ ટીપાં ઉમેરો.
- બંને કસનળીને એકસમાન સમય સુધી હલાવો.
પ્રશ્નો :
પ્રશ્ન 1. શું બંને કસનળીઓ ફીણનું સમાન પ્રમાણ ધરાવે છે?
ઉત્તર: બંને કસનળીઓ ફીણનું સમાન પ્રમાણ ધરાવતી નથી. જે કસનળીમાં સાબુના દ્રાવણનાં ટીપાં ઉમેર્યા છે, તેમાં ફીણની માત્રા ઓછી છે.
પ્રશ્ન 2. કઈ કસનળીમાં દહીં જેવો ઘન પદાર્થ ઉદ્ભવે છે?
ઉત્તર: જે કસનળીમાં સાબુનું દ્રાવણ ઉમેર્યું છે, તે કસનળીમાં દહીં જેવો ઘન પદાર્થ ઉદ્ભવે છે.
Science Notes Chapter 4 કાર્બન અને તેનાં સંયોજનો
કાર્બન અને તેનાં સંયોજનો Class 10 Notes
→ તમામ સજીવ સંરચનાઓ (પ્રાણીઓ અને વનસ્પતિઓ) કાર્બન પર આધારિત છે.
→ પૃથ્વીના પોપડામાં ખનિજ સ્વરૂપે કાર્બન 0.02 % છે.
→ તત્ત્વોની સક્રિયતા સંપૂર્ણ ભરાયેલ બાહ્ય કોશ એટલે કે નિષ્ક્રિય વાયુ જેવી રચના પ્રાપ્ત કરવાની વૃત્તિને આધારે સમજાવી શકાય છે.
→ સહસંયોજક બંધ (covalent Bond) : બે કે તેથી વધુ પરમાણુઓ વચ્ચે ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા રચાતા બંધને સહસંયોજક બંધ કહે છે.
→ કાર્બનનાં ત્રણ અપરરૂપો છે :
- હીરો,
- ગ્રેફાઈટ અને
- ફુલેરિન.
→ કેટેનેશન (Catenation) : કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ સાથે બંધ બનાવવાની અદ્વિતીય ક્ષમતા ધરાવે છે, જેથી વધુ સંખ્યામાં અણુઓ (સંયોજનો) બને છે. કાર્બનના આ ગુણધર્મને કેટેનેશન કહે છે.
→ જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એકલબંધથી જોડાયેલા હોય તેવાં સંયોજનોને સંતૃપ્ત કાર્બન સંયોજનો (Saturated carbon compound) કહે છે. જ્યારે જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ તિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં સંયોજનોને અસંતૃપ્ત કાર્બન સંયોજનો (Unsaturated carbon compound) કહે છે.
→ અસંતૃપ્ત કાર્બન સંયોજનો સંતૃપ્ત કાર્બન સંયોજનો કરતાં વધુ | ક્રિયાશીલ છે. 9. બંધારણીય સમઘટકો (Structural isomers) સમાન આણ્વીય સૂત્ર પરંતુ ભિન્ન બંધારણો ધરાવતાં સંયોજનોને બંધારણીય સમઘટકો કહે છે.
→ હાઇડ્રોકાર્બન સંતૃપ્ત હાઇડ્રોકાર્બનને આલ્કન કહે છે. અસંતૃપ્ત હાઈડ્રોકાર્બન કે જે એક અથવા વધુ દ્વિબંધ ધરાવે છે, તેને આલ્કીન તથા એક અથવા વધુ ત્રિબંધ ધરાવે છે, તેને આલ્ફાઈન કહે છે.
→ ક્રિયાશીલ સમૂહો (Functional groups) : વિષમ પરમાણુઓ અને તેમને સમાવતા સમૂહો કે જે સંયોજનોને વિશિષ્ટ ગુણધર્મો આપે છે, જે કાર્બન-શૃંખલાની લંબાઈ અને સ્વભાવ પર આધારિત નથી, તેમને ક્રિયાશીલ સમૂહો કહે છે.
→ સમાનધર્મી શ્રેણી (Homologous series) કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન શૃંખલામાં રહેલ હાઈડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
→ ઑક્સિડેશનકર્તા (Oxidising agent) કેટલાક પદાર્થો અન્ય પદાર્થોમાં ઑક્સિજન ઉમેરવા માટે સક્ષમ હોય છે, જેને ઑક્સિડેશનકર્તા કહે છે. દા. ત., આલ્કલાઈન પોટૅશિયમ પરમેંગેનેટ, ઍસિડિક પોટેશિયમ ડાયક્રોમેટ.
→ યોગશીલ પ્રક્રિયા (Addition reaction): જે રાસાયણિક પ્રક્રિયા દરમિયાન કાર્બનિક સંયોજનોમાં બીજો અણુ ઉમેરાવાથી નવું કાર્બનિક સંયોજન બને, તો તે પ્રક્રિયાને યોગશીલ પ્રક્રિયા કહે છે.
→ વિસ્થાપન પ્રક્રિયા (Substitution reaction) જે પ્રક્રિયામાં કાર્બનિક સંયોજનોના અણુમાં રહેલા પરમાણુ કે પરમાણુઓના સમૂહનું અન્ય પરમાણુ કે પરમાણુઓના સમૂહ વડે વિસ્થાપન થાય, તો તે પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છ
→ એસ્ટરીકરણ (Esterification) : ખનીજ ઍસિડ ઉદ્દીપકની હાજરીમાં કાર્બોક્સિલિક ઍસિડ અને પરિશુદ્ધ આલ્કોહોલ વચ્ચેની પ્રક્રિયાથી એસ્ટર અને પાણી નીપજે છે. આ પ્રક્રિયાને એસ્ટરીકરણ કહે છે.
→ સાબુનીકરણ (Sapotification) એસ્ટરમાંથી આલ્કોહોલ અને કાબૉક્સિલિક ઍસિડના સોડિયમ ક્ષારમાં રૂપાંતર થવાની ક્રિયાને સાબુનીકરણ કહે છે.
→ સાબુ અને પ્રક્ષાલકની પ્રક્રિયા અણુમાં રહેલા જલાનુરાગી અને જલવિતરાગી સમૂહોની હાજરી પર આધારિત છે. તેની મદદથી તૈલી મેલનું પાયસ રચાય છે અને તે દૂર થાય છે.


