Chapter 5 તત્ત્વોનું આવર્તી વર્ગીકરણ

તત્ત્વોનું આવર્તી વર્ગીકરણ Textbook Questions and Answers
સ્વાધ્યાયના પ્રશ્નોત્તર
પ્રશ્નો 1
આવર્ત કોષ્ટકમાં ડાબીથી જમણી તરફ જતાં બદલાતા વલણ વિશે નીચેના વિધાનો પૈકી કયું વિધાન સાચું નથી?
(a) તત્ત્વનો ધાત્વીય ગુણ ઘટતો જાય છે.
(b) સંયોજકતા ઇલેક્ટ્રૉનની સંખ્યા વધતી જાય છે.
(c) પરમાણુઓ સહેલાઈથી તેમના ઈલેક્ટ્રૉન ગુમાવે છે.
(d) ઑક્સાઇડ વધુ ઍસિડિક બને છે.
પ્રશ્નો 2. તત્ત્વ X એ xcl2 સૂત્ર ધરાવતો ક્લોરાઇડ બનાવે છે જે ઊંચું ગલનબિંદુ ધરાવતો ઘન પદાર્થ છે. X મહદંશે એવા સમાન સમૂહમાં હશે કે જેમાં …………. હશે.
(a) Na
(b) Mg
(c) AI
(d) Si
પ્રશ્નો 3. કયા તત્ત્વમાં
(a) બે કક્ષાઓ છે તથા બંને ઇલેક્ટ્રૉનથી સંપૂર્ણ ભરાયેલ છે? (a) નિયોન (2, 8)
(b) ઇલેક્ટ્રૉન-રચના 2, 8, 2 છે? (b) મૅગ્નેશિયમ (2, 8, 2)
(c) કુલ ત્રણ કક્ષા છે કે જે સંયોજકતા કક્ષામાં ચાર ઇલેક્ટ્રૉન ધરાવે છે? (c) સિલિકોન (2, 8, 4)
(d) કુલ બે કક્ષા છે કે જે સંયોજકતા કક્ષામાં ત્રણ ઇલેક્ટ્રૉન ધરાવે છે? (d) બોરોન (2, 3).
(e) બીજી કક્ષામાં પ્રથમ કક્ષા કરતાં બમણા ઇલેક્ટ્રૉન છે? (e) કાર્બન (2, 4)
પ્રશ્નો 3
(a) આવર્ત કોષ્ટકમાં બોરોન જે સમૂહમાં છે, તે જ સમૂહનાં તમામ ? તત્ત્વોનો કયો ગુણધર્મ સમાન છે? – (a) આધુનિક આવર્ત કોષ્ટકમાં બોરોન એ સમૂહ 13નું તત્ત્વ છે. તેની સંયોજકતા 3 છે. આથી આ સમૂહનાં બધાં જ તત્ત્વોની સંયોજકતા 3 છે.
(b) આવર્ત કોષ્ટકમાં ફ્લોરિન જે સમૂહમાં છે, તે જ સમૂહનાં તમામ તત્ત્વોનો કયો ગુણધર્મ સમાન છે? – (b) આધુનિક આવર્ત કોષ્ટકમાં ફ્લોરિન એ સમૂહ 17નું તત્ત્વ છે. આ સમૂહનાં બધાં જ તત્ત્વોની સંયોજકતા કક્ષામાં 7 ઇલેક્ટ્રૉન છે. આથી આ સમૂહનાં બધાં જ તત્ત્વોની સંયોજકતા 1 છે.
પ્રશ્નો 3
એક પરમાણુની ઇલેક્ટ્રૉનીય-રચના 2, 8, 7 છે.
(a) આ તત્ત્વનો પરમાણ્વીય ક્રમાંક કેટલો છે? – (a) આ તત્ત્વનો પરમાણ્વીય ક્રમાંક = 2 + 8 + 7 = 17
(b) નીચેના પૈકી કયા તત્ત્વ સાથે તે રાસાયણિક રીતે સમાનતા ધરાવતું હશે? (પરમાણ્વીય ક્રમાંક કસમાં આપેલ છે.).
N (7) F (9) P (15) Ar (18) (b) F (9) (∵ Fની ઇલેક્ટ્રૉનીય રચના : 2, 7 છે.)
પ્રશ્નો 3 આવર્ત કોષ્ટકમાં ત્રણ તત્ત્વો A, B તથા cનું સ્થાન નીચે દર્શાવેલ છે :

જણાવો કે,
(a) તત્ત્વ A ધાતુ છે કે અધાતુ? – (a) તત્ત્વ A એ સમૂહ 17નું તત્ત્વ છે. તેની સંયોજકતા કક્ષામાં 7 ઇલેક્ટ્રૉન હોવાથી આ તત્ત્વ એક ઇલેક્ટ્રૉન મેળવી અષ્ટક રચના પૂર્ણ કરે છે. આથી તત્ત્વ A અધાતુ તત્ત્વ છે.
(b) તત્ત્વ Aની સરખામણીમાં તત્ત્વ : વધુ પ્રતિક્રિયાત્મક છે કે ઓછું? – (b) સમૂહમાં ઉપરથી નીચે તરફ જતાં પરમાણ્વીય કદ વધે છે. આથી કેન્દ્રથી ઇલેક્ટ્રૉનનું આકર્ષણ ઘટે છે. પરિણામે સરળતાથી ઇલેક્ટ્રૉન દાખલ થઈ શકશે નહિ. આમ, ત્રણ આયન બનવાની વૃત્તિના સંદર્ભમાં તત્ત્વ Cની સક્રિયતા તત્ત્વ A કરતાં ઓછી છે. પરંતુ ઇલેક્ટ્રૉન ગુમાવી ધન આયન બનવાની વૃત્તિના સંદર્ભમાં તત્ત્વ Cની સક્રિયતા તત્ત્વ A કરતાં વધુ છે.
(c) તત્ત્વ cનું કદ તત્ત્વ B કરતાં મોટું હશે કે નાનું? – (c) તત્ત્વ B અને C એક જ આવર્ત(4)નાં તત્ત્વો છે. આવર્તમાં ડાબી બાજુથી જમણી બાજુ તરફ જતાં પરમાણ્વીય કદ ઘટે છે. આથી તત્ત્વ Cનું પરમાણ્વીય કદ તત્ત્વ B કરતાં નાનું છે.
(d) તત્ત્વ A કયા પ્રકારના આયન – ધનાયન કે ઋણાયન બનાવશે? – (d) તત્ત્વ Aની સંયોજકતા કક્ષામાં 7 ઇલેક્ટ્રૉન હોવાથી અષ્ટક રચના પૂર્ણ કરવા માટે એક ઇલેક્ટ્રૉન મેળવશે. આથી તત્ત્વ A ઋણાયન બનાવશે. A + e– → A–.
પ્રશ્નો 3 નાઇટ્રોજન (પરમાણ્વીય ક્રમાંક 7) તથા ફૉસ્ફરસ (પરમાણ્વીય ક્રમાંક 15) આવર્ત કોષ્ટકના સમૂહ 15ના સભ્યો છે. આ બંને તત્ત્વોની ઇલેક્ટ્રૉનીય-રચના લખો. આમાંથી કયું તત્ત્વ વધુ વિદ્યુતકણમય હશે? શા માટે?
ઉત્તર: નાઇટ્રોજન અને ફૉસ્ફરસની ઇલેક્ટ્રૉનીય રચના નીચે મુજબ છે :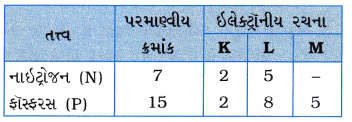
નાઇટ્રોજન એ ફૉસ્ફરસ કરતાં વધુ વિદ્યુતઋણમય તત્ત્વ છે, કારણ કે સમૂહમાં ઉપરથી નીચે તરફ જતાં વિદ્યુતઋણતા ઘટે છે.
પ્રશ્નો 3 પરમાણુની ઇલેક્ટ્રૉનીય-રચના તેના આધુનિક આવર્ત કોષ્ટકના : સ્થાન સાથે શો સંબંધ છે?
ઉત્તર: આવર્ત કોષ્ટકમાં તત્ત્વનું સ્થાન તત્ત્વની ઇલેક્ટ્રૉનીય રચના પર આધાર રાખે છે. ઇલેક્ટ્રૉન-રચનામાં દર્શાવેલ સંયોજકતા ઇલેક્ટ્રૉન દ્વારા તત્ત્વ કયા સમૂહમાં આવેલું છે, તે નક્કી કરી શકાય છે.

Naની ઇલેક્ટ્રૉન-રચનામાં સંયોજકતા કક્ષામાં 1 ઇલેક્ટ્રૉન હોવાથી તે સમૂહ નું તત્ત્વ છે તેમ કહી શકાય.
તત્ત્વની ઇલેક્ટ્રૉન-રચનામાં દર્શાવેલી કક્ષાની સંખ્યાના આધારે તે ક્યા આવર્તનું તત્ત્વ છે, તે નક્કી કરી શકાય ![]() રચનામાં ત્રણ કક્ષાઓ હોવાથી તે ત્રીજા આવર્તનું
રચનામાં ત્રણ કક્ષાઓ હોવાથી તે ત્રીજા આવર્તનું
તત્ત્વ છે તેમ કહી શકાય.
પ્રશ્નો 3 આધુનિક આવર્ત કોષ્ટકમાં કેલ્શિયમ(પરમાણ્વીય ક્રમાંક 20)ની ચારે તરફ 12, 19, 21 તથા 38 પરમાણ્વીય ક્રમાંક ધરાવતાં તત્ત્વો રહેલાં છે. આમાંથી કયાં તત્ત્વોના ભૌતિક અને રાસાયણિક ગુણધર્મો કૅલ્શિયમ જેવા જ છે?
ઉત્તર:તત્વ પરમાણુ ક્રમાંક ઇલેક્ટ્રોનિક રચના
K L M N O
કેલ્શિયમ 20 2 8 8 2 –
મેગ્નેશિયમ 12 2 8 2 – –
પોટેશિયમ 19 2 8 8 1 –
સોડિયમ 11 2 8 1 – –
સ્ટ્રોન્ટિયમ 38 2 8 18 8 2
પરમાણ્વીય ક્રમાંક 20 અને 38ની બાહ્યતમ કક્ષામાં સમાન (2) ઇલેક્ટ્રૉન હોવાથી તેમના રાસાયણિક ગુણધર્મો સમાન છે.
પ્રશ્નો 3 મેન્ડેલીફના આવર્ત કોષ્ટકમાં અને આધુનિક આવર્ત કોષ્ટકમાં તત્ત્વોની ગોઠવણીમાં સમાનતા અને ભિન્નતા દર્શાવો.
ઉત્તર:

તત્ત્વોનું આવર્તી વર્ગીકરણ Intext Questions and Answers
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 85]
પ્રશ્ન 1. શું ડોબરેનરની ત્રિપુટી જુલૅન્ડના અષ્ટકના સમૂહમાં પણ જોવા મળે છે? સરખામણી કરી શોધી કાઢો.
ઉત્તર: ડોબરેનરની ત્રિપુટી જુલૅન્ડના અષ્ટકના સમૂહમાં પણ જોવા મળે છે.
- લિથિયમ, સોડિયમ અને પોટેશિયમ એ ડોબરેનરની ત્રિપુટી છે.
- આ ત્રિપુટીમાંનું પ્રથમ તત્ત્વ લિથિયમને જો અષ્ટકના સિદ્ધાંત મુજબ પ્રથમ તત્ત્વ ગણીએ, તો તેનાથી આઠમા ક્રમે આવતું તત્ત્વ સોડિયમ છે. આ બંને તત્ત્વો બંને નિયમ મુજબ ગુણધર્મોમાં સમાનતા ધરાવે છે.
- આ જ પ્રમાણે ત્રિપુટીનું દ્વિતીય તત્ત્વ સોડિયમને જો અષ્ટકના સિદ્ધાંત મુજબ પ્રથમ તત્ત્વ ગણીએ, તો તેનાથી આઠમા ક્રમે આવતું તત્ત્વ પોટેશિયમ છે. આ બંને તત્ત્વો પણ બંને નિયમ મુજબ ગુણધમોંમાં સમાનતા ધરાવે છે.
- આ ઉપરાંત, બીજાં કેટલાંક તત્ત્વો જેવાં કે; બેરિલિયમ (Be), મૅગ્નેશિયમ (Mg) અને કૅલ્શિયમ (Ca) પણ ત્રિપુટી તેમજ અષ્ટકના સિદ્ધાંતનું પાલન કરે છે.
આમ, ડોબરેનરની ત્રિપુટી જુલૅન્ડના અષ્ટકના સમૂહમાં પણ જોવા મળે છે.
પ્રશ્ન 2. ડોબરેનરના વર્ગીકરણની મર્યાદાઓ શું છે?
ઉત્તરઃ ડોબરેનરના વર્ગીકરણની મર્યાદાઓ નીચે મુજબ છેઃ
- ડોબરેનરના સમયમાં જાણીતાં બધાં જ તત્ત્વોનું વર્ગીકરણ કરી શકાયું નહિ. તેથી ત્રિપુટીમાં વર્ગીકૃત કરવાની આ પદ્ધતિ સફળ ગણી શકાય નહિ.
- તે સમયમાં N, P અને As એ ત્રણ તત્ત્વો પણ જાણીતાં હતાં. પરંતુ આ તત્ત્વોને ત્રિપુટીમાં વર્ગીકૃત કરી શકાયાં ન હતાં.
પ્રશ્ન 3. ન્યૂલેન્ડના અષ્ટકના સિદ્ધાંતની મર્યાદાઓ શું છે?
અથવા
ન્યુલૅન્ડના અષ્ટકના સિદ્ધાંતની મર્યાદાઓ જણાવો.
ઉત્તર: ન્યુલૅન્ડના અષ્ટકના સિદ્ધાંતની મર્યાદાઓ નીચે મુજબ છે :
- જુલૅન્ડનો અષ્ટકનો સિદ્ધાંત માત્ર હલકાં તત્ત્વો(પરમાણ્વીય દળ < 40 u)ને લાગુ પડ્યો.
- અષ્ટકનો સિદ્ધાંત માત્ર Ca સુધી જ લાગુ પડતો હતો, કારણ કે Ca પછી પ્રત્યેક આઠમા તત્ત્વના ગુણધર્મ પહેલા તત્ત્વના ગુણધર્મને મળતા આવતા નથી.
- જુલૅન્ડ કલ્પના કરી હતી કે કુદરતમાં માત્ર 56 તત્ત્વો હાજર છે અને ભવિષ્યમાં કોઈ અન્ય તત્ત્વ શોધાશે નહીં. પરંતુ ત્યારબાદ અનેક નવાં તત્ત્વો શોધાયાં, જેના ગુણધર્મો અષ્ટકના સિદ્ધાંત સાથે બંધબેસતા નથી.
- જુલૅન્ડે પોતાના કોષ્ટકમાં તત્ત્વોને બંધબેસતા બેસાડવા માટે બે તત્ત્વો(CA અને NI)ને એક જ સ્થાન પર ગોઠવી દીધાં હતાં. ઉપરાંત કેટલાંક અસમાન તત્ત્વોને પણ એક જ સ્થાન પર ગોઠવ્યાં હતાં. દા. ત., CA અને Ni એ બે તત્ત્વોને જુલૅન્ડે F, CI, Br સાથે ગોઠવ્યાં હતાં. જ્યારે Fe એ CO અને Ni સાથે ગુણધર્મોમાં સમાનતા ધરાવે છે, પરંતુ Feનું સ્થાન તેમના કરતાં અલગ રાખ્યું હતું.
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 85]
પ્રશ્ન 1. મેન્ડેલીફના આવર્ત કોષ્ટકનો ઉપયોગ કરી, નીચેનાં તત્ત્વોના ઑક્સાઇડનાં સૂત્રોનું અનુમાન લગાવો :
K, c, Al, si, Ba
ઉત્તર :

પ્રશ્ન 2. ગેલિયમ સિવાય અત્યાર સુધી કયાં કયાં તત્ત્વો વિશે જાણ થઈ છે, જેના માટે મેન્ડેલીફે પોતાના આવર્ત કોષ્ટકમાં ખાલી સ્થાન છોડ્યું હતું? (ગમે તે બ)
ઉત્તર: ગેલિયમ સિવાય જર્મોનિયમ અને સ્ટેન્ડિયમ માટે મેન્ડેલીફે પોતાના આવર્ત કોષ્ટકમાં ખાલી સ્થાન છોડ્યાં હતાં.
પ્રશ્ન 3. મેન્ડેલીફે પોતાનું આવર્ત કોષ્ટક તૈયાર કરવા માટે કયાં માપદંડ લીધા?
ઉત્તર: મેન્ડેલીફે તત્ત્વોનું આવર્ત કોષ્ટક તૈયાર કરવા માટે નીચેના માપદંડ ધ્યાનમાં લીધા :
- તત્ત્વોના ગુણધર્મો તેમના પરમાણ્વીય દળના આવર્તનીય વિધેય છે.
- સમાન ગુણધર્મોવાળાં તત્ત્વોને એક સમૂહમાં ગોઠવવા.
- તત્ત્વ દ્વારા બનતા ઑક્સાઇડ અને હાઇડ્રાઇડના આણ્વીય સૂત્રનો ઉપયોગ.
પ્રશ્ન 4. તમારા મત મુજબ નિષ્ક્રિય વાયુને શા માટે અલગ સમૂહમાં રાખવામાં આવ્યા?
ઉત્તર: નિષ્ક્રિય વાયુઓ જેવા કે હિલિયમ (He), નિયોન (Ne) અને આગન(Ar)નું વાતાવરણમાં અતિશય અલ્પ પ્રમાણ અને રાસાયણિક નિષ્ક્રિયતાને કારણે અલગ સમૂહમાં રાખવામાં આવ્યા છે.
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 90]
પ્રશ્ન 1. આધુનિક આવર્ત કોષ્ટક મેન્ડેલીફના આવર્ત કોષ્ટકની વિસંગતતાઓ કેવી રીતે દૂર કરી શક્યું?
ઉત્તર: આધુનિક આવર્ત કોષ્ટક મેન્ડેલીફના આવર્ત કોષ્ટકની વિસંગતતાઓ નીચે મુજબ દૂર કરી શક્યું :
- સમસ્થાનિકોનું સ્થાન સમસ્થાનિકોના પરમાણ્વીય ક્રમાંક સમાન હોવાથી આવર્ત કોષ્ટકમાં એક જ તત્ત્વના બધા જ સમસ્થાનિકોને એક જ સ્થાને મૂકવામાં આવે છે.
- કેટલાંક સમાન તત્ત્વોની જોડનું સ્થાન મેન્ડેલીફના આવર્ત કોષ્ટકમાં સમાન ગુણધર્મો ધરાવતાં તત્ત્વો એકસાથે ગોઠવાયાં હતાં. જેમ કે, કોબાલ્ટ (Co) (પરમાણ્વીય દળ 58.9 u) એ નિકલ (NI) (પરમાણ્વીય દળ 58.7 u) કરતાં પહેલાં મૂકવામાં આવ્યું હતું. જ્યારે આધુનિક આવર્ત કોષ્ટક એ પરમાણ્વીય ક્રમાંકના આધારે રચાયું હોવાથી નિકલનો પરમાણ્વીય ક્રમાંક 27 અને કોબાલ્ટનો પરમાણ્વીય ક્રમાંક 28 હોઈ કોબાલ્ટનું સ્થાન નિકલ બાદ ગોઠવાયું.
- નવાં તત્ત્વોની શોધ માટેની અનિશ્ચિતતાઃ મેન્ડેલીફના આવર્ત કોષ્ટકમાં પરમાણ્વીય દળનો ચડતો ક્રમ એ યોગ્ય નિયમિતતા ધરાવતો નથી. આથી એક તત્ત્વ પછી નવા કયા તત્ત્વ વિશે સંશોધન કરવું અથવા તેના વિશે આગાહી કરવી ખૂબ જ મુશ્કેલ હતું.
આધુનિક આવર્ત કોષ્ટક પરમાણ્વીય ક્રમાંક પર રચાયું હોવાથી નવાં તત્ત્વોના સંશોધન-કાર્યને વેગ મળ્યો.
પ્રશ્ન 2. તમારી ધારણા મુજબ મૅગ્નેશિયમ જેવી રાસાયણિક પ્રક્રિયાઓ દર્શાવતાં બે તત્ત્વોનાં નામ આપો. તમારી પસંદગીનો આધાર શું છે?
ઉત્તર: આધુનિક આવર્ત કોષ્ટકમાં જે તત્ત્વોની બાહ્યતમ કક્ષામાં ઇલેક્ટ્રૉનની સંખ્યા સમાન હોય તેવાં તત્ત્વો સમાન રાસાયણિક પ્રક્રિયાઓ દર્શાવે છે.
- મૅગ્નેશિયમની બાહ્યતમ કક્ષામાં 2 ઇલેક્ટ્રૉન છે. આથી બાહ્યતમ કક્ષામાં 2 ઇલેક્ટ્રૉન હોય તેવાં તત્ત્વો બેરિલિયમ (Be), કૅલ્શિયમ (Ca) અને સ્ટ્રૉન્શિયમ (Sr) સમાન રાસાયણિક પ્રક્રિયાઓ દર્શાવે છે.

પ્રશ્ન 3. નામ આપો :
(a) ત્રણ તત્ત્વો કે જે તેમની બાહ્યતમ કક્ષામાં એક ઇલેક્ટ્રૉન ધરાવે છે. – (a) લિથિયમ (Li), સોડિયમ (Na), પોટેશિયમ (K)
(b) બે તત્ત્વો કે જે તેમની બાહ્યતમ કક્ષામાં બે ઇલેક્ટ્રૉન ધરાવે છે. – (b) મૅગ્નેશિયમ (Mg), કૅલ્શિયમ (Ca)
(c) સંપૂર્ણ ભરાયેલી બાહ્યતમ કક્ષા ધરાવતાં ત્રણ તત્ત્વો. – (c) નિયોન (Ne), આર્ગોન (Ar), ક્રિપ્ટોન (Kr)
પ્રશ્ન 4.
(a) લિથિયમ, સોડિયમ, પોટેશિયમ આ બધી એવી ધાતુઓ છે કે જે પાણી સાથે પ્રક્રિયા કરી હાઇડ્રોજન વાયુ મુક્ત કરે છે. આ તત્ત્વોના પરમાણુઓમાં કોઈ સમાનતા છે?
ઉત્તર: લિથિયમ, સોડિયમ, પોટેશિયમ આ બધી આલ્કલી ધાતુ તત્ત્વો પાણી સાથે પ્રક્રિયા કરી હાઇડ્રોજન વાયુ મુક્ત કરે છે.
દા. ત., 2M + 2H2O → 2MOH + H2![]() M = Li ; Na
M = Li ; Na ![]() K
K
આ બધી જ ધાતુઓની બાહ્યતમ કક્ષામાં 1 ઇલેક્ટ્રૉન છે, અર્થાત્ તેમની ઇલેક્ટ્રૉન-રચના સમાન છે.
(b) હિલિયમ અને નિયોન બંને નિષ્ક્રિય વાયુ તત્ત્વો છે. બંને તત્ત્વોની બાહ્યતમ કક્ષા ઈલેક્ટ્રૉનથી સંપૂર્ણ ભરાયેલી છે. Heની – K કક્ષામાં 2, જ્યારે Neની L કક્ષામાં 8 ઇલેક્ટ્રૉન ગોઠવાયેલા છે.
ઉત્તર: હિલિયમ એક નિષ્ક્રિય વાયુ છે, જ્યારે નિયોનની પ્રતિક્રિયાત્મકતા ખૂબ જ ઓછી છે. તેમના પરમાણુઓમાં કોઈ સમાનતા છે?
પ્રશ્ન 5. આધુનિક આવર્ત કોષ્ટકમાં પ્રથમ દસ તત્ત્વોમાં કઈ ધાતુઓ છે?
ઉત્તર: આધુનિક આવર્ત કોષ્ટકમાં પ્રથમ દસ તત્ત્વો નીચે મુજબ છેઃ 1H, 2He, 3Li, 4Be, 5B, 6C, 7N, 8O, 9F ![]() 10Ne
10Ne
- આ દસ તત્ત્વો પૈકી L અને Be એમ બે જ તત્ત્વો ધાતુ તત્ત્વો છે.
પ્રશ્ન 6. આવર્ત કોષ્ટકમાં તત્ત્વના સ્થાનને ધ્યાનમાં લેતાં નીચે ! દર્શાવેલાં તત્ત્વો પૈકી કયું તત્ત્વ તમારી ધારણા અનુસાર સૌથી વધુ ધાત્વીય લક્ષણ ધરાવે છે?
Ga, Ge, As, Se, Be
ઉત્તર: Ga અને Be સૌથી વધુ ધાત્વીય લક્ષણ ધરાવે છે. આપેલ તત્ત્વોની ગોઠવણી નીચે મુજબ છે :

તત્ત્વોનું આવર્તી વર્ગીકરણ Textbook Activities
પ્રવૃત્તિ 5.1 [પા.પુ. પાના નં. 84]
- હાઇડ્રોજનની આલ્કલી ધાતુઓ અને હેલોજન પરિવાર સાથેની સમાનતાને જોતાં તેને મેન્ડેલીફના આવર્ત કોષ્ટકમાં યોગ્ય સ્થાન પર મૂકો.
- હાઇડ્રોજનને કયા સમૂહ અને આવર્તમાં રાખવું જોઈએ?
ચર્ચા: હાઇડ્રોજન એ નીચો પરમાણ્વીય ક્રમાંક (Z = 1) અને ઓછું પરમાણ્વીય દળ (1.008 u) ધરાવતું તત્ત્વ છે. - હાઇડ્રોજનની ઇલેક્ટ્રૉન-રચના આલ્કલી ધાતુ તત્ત્વોને મળતી આવે છે.
- આલ્કલી ધાતુ તત્ત્વોની જેમ હાઇડ્રોજન પણ હેલોજન, ઑક્સિજન અને સલ્ફર સાથે સમાન આણ્વીય સૂત્ર ધરાવતાં સંયોજનો બનાવે છે.
આથી હાઇડ્રોજનને આલ્કલી ધાતુ તત્ત્વો સાથે સમૂહ(IA)માં સ્થાન મળવું જોઈએ.
- હાઇડ્રોજન એ હેલોજન તત્ત્વોની માફક ઢિપરમાણ્વીય અણુ સ્વરૂપે અસ્તિત્વ ધરાવે છે. તેમજ ધાતુઓ અને અધાતુઓ સાથે અનુક્રમે આયોનિક અને સહસંયોજક બંધ બનાવે છે.
આથી હાઇડ્રોજનને હેલોજન તત્ત્વો સાથે સમૂહ(VI)માં સ્થાન મળવું જોઈએ.
નિર્ણયઃ આમ, હાઇડ્રોજનનું આવર્ત કોષ્ટકમાં સ્થાન ચર્ચાસ્પદ છે. તેમ છતાં તેને સમૂહ I અને આવર્ત 1માં મૂકી શકાય.
પ્રવૃત્તિ 5.2 [પા.પુ. પાના નં. 85].
- ક્લોરિનના સમસ્થાનિક Cl-35 અને C-37 ધ્યાનમાં લો.
- ક્લોરિનના બે સમસ્થાનિકો Cl-35 અને CI-37 જાણીતાં છે.
- આ બંને સમસ્થાનિકોના પરમાણ્વીય ક્રમાંક 17 છે. આથી બંનેની ઇલેક્ટ્રૉન-રચના અને રાસાયણિક ગુણધર્મો સમાન છે, પરંતુ પરમાણ્વીય દળ ભિન્ન છે.
- તેમનાં પરમાણ્વીય દળ જુદાં જુદાં હોવાથી શું તમે તેઓને અલગ અલગ સ્થાન પર મૂકશો?
- મેન્ડેલીફના આવર્ત નિયમ મુજબ “તત્ત્વોના ગુણધર્મો તેમના પરમાણ્વીય દળના આવર્તનીય વિધેય છે.”
- આથી મેન્ડેલીફના નિયમ મુજબ આ બંને સમસ્થાનિકોને તેમના પરમાણ્વીય દળના ચડતા ક્રમ મુજબ ગોઠવવામાં આવે, તો તેમનું સ્થાન K (39.1 u) પહેલાં રાખવું પડે. પરંતુ ત્યાં કોઈ સ્થાન ખાલી નથી. આથી અલગ અલગ સ્થાન પર મૂકી શકાય નહિ.
- તેમના રાસાયણિક ગુણધર્મો સમાન હોવાથી તમે તેમને એક જ સ્થાન પર રાખશો?
- રાસાયણિક ગુણધર્મો સમાન હોવાથી એક જ સ્થાન પર ગોઠવી શકાય.
પ્રવૃત્તિ 5.3 [પા.પુ. પાના નં. 85]
પ્રશ્ન 1.
આધુનિક આવર્ત કોષ્ટકમાં નિકલ અને કોબાલ્ટનાં સ્થાન કેવી રીતે નિશ્ચિત કરવામાં આવ્યાં છે?
ઉત્તર: આધુનિક આવર્ત કોષ્ટકમાં તત્ત્વોનું વર્ગીકરણ પરમાણ્વીય – ક્રમાંકના આધારે કરવામાં આવ્યું છે.
- કોબાલ્ટ અને નિકલનો પરમાણ્વીય ક્રમાંક અનુક્રમે 27 અને 28 છે. તેથી બંને તત્ત્વોને તેમના પરમાણ્વીય ક્રમાંકના ચડતા ક્રમના આધારે અનુક્રમે સમૂહ 9 અને 10માં સ્થાન નિશ્ચિત કરવામાં આવ્યાં છે.
પ્રશ્ન 2. આધુનિક આવર્ત કોષ્ટકમાં જુદાં જુદાં તત્ત્વોના સમસ્થાનિકોનાં સ્થાન કેવી રીતે નિશ્ચિત કરવામાં આવ્યાં છે?
ઉત્તર: આધુનિક આવર્ત કોષ્ટકમાં જુદાં જુદાં તત્ત્વોના સમસ્થાનિકોનાં સ્થાન કોઈ અલગ રીતે નિશ્ચિત કરવામાં આવ્યાં નથી. એક જ તત્ત્વના બધા જ સમસ્થાનિકોને એક જ સ્થાનમાં રાખવામાં આવ્યાં છે.
પ્રશ્ન 3. શું 1.5 પરમાણ્વીય ક્રમાંક ધરાવતા તત્ત્વને હાઇડ્રોજન અને હિલિયમની વચ્ચે રાખવું શક્ય છે?
ઉત્તર: પરમાણ્વીય ક્રમાંક એ નિશ્ચિત અને પૂર્ણાંક સંખ્યા છે.
- આધુનિક આવર્ત કોષ્ટકમાં તત્ત્વોને પરમાણ્વીય ક્રમાંકના ચડતા ક્રમમાં ગોઠવવામાં આવે છે.
- પરમાણ્વીય ક્રમાંક અપૂર્ણાંક હોઈ શકે નહિ. આથી 1.5 પરમાણ્વીય ક્રમાંક ધરાવતા તત્ત્વને હાઇડ્રોજન અને હિલિયમની વચ્ચે રાખવું શક્ય નથી.
પ્રશ્ન 4. આધુનિક આવર્ત કોષ્ટકમાં હાઇડ્રોજનને ક્યાં રાખવું જોઈએ?
ઉત્તર: આધુનિક આવર્ત કોષ્ટકમાં હાઇડ્રોજનને આવર્ત 1માં અને આવર્ત કોષ્ટકની મધ્યમાં રાખવું જોઈએ. (અર્થાત્ હાઇડ્રોજન માટે સમૂહ ક્રમાંક નક્કી કરી શકાય નહિ.)
પ્રવૃત્તિ 5.5 [પા.પુ. પાના નં. 87]
પ્રશ્ન 1. જો તમે આવર્ત કોષ્ટકના લાંબા સ્વરૂપને જોશો, તો ખ્યાલ આવશે કે Li, Be, B, C, N, 0, ” અને Ne બીજા આવર્તનાં તત્ત્વો છે. તેમની ઇલેક્ટ્રૉન-રચના લખો.
ઉત્તર :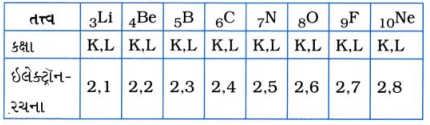
પ્રશ્ન 2. શું આ બધાં તત્ત્વો પણ સમાન સંખ્યામાં સંયોજકતા ઇલેક્ટ્રૉન ધરાવે છે?
ઉત્તર: આ બધાં તત્ત્વો સમાન સંખ્યામાં સંયોજક્તા ઇલેક્ટ્રૉન ધરાવતા નથી.
પ્રશ્ન ૩. શું તેઓ સમાન સંખ્યાની કક્ષાઓ ધરાવે છે?
ઉત્તર: આ બધાં તત્ત્વો સમાન સંખ્યામાં કક્ષાઓ (2 – K, L) ધરાવે છે.
પ્રવૃત્તિ 5.6 [પા.પુ. પાના નં. 88]
પ્રશ્ન 1. તમે કોઈ પણ તત્ત્વની ઇલેક્ટ્રૉન-રચનાના આધારે તેની સંયોજકતાની ગણતરી કેવી રીતે કરશો?
ઉત્તર: કોઈ પણ તત્ત્વની ઇલેક્ટ્રૉન-રચનામાં બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યા પરથી સંયોજકતાની ગણતરી કરી શકાય છે.
- સમૂહ 1, 2, 13 અને 14 માટે સંયોજકતાનું મૂલ્ય બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યા જેટલું; પરંતુ સમૂહ 15, 16, 17 અને 18 માટે સંયોજકતાનું મૂલ્ય 8માંથી બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યાને બાદ કરતાં મળતા મૂલ્ય જેટલું હોય છે.
પ્રશ્ન 2. પરમાણ્વીય ક્રમાંક 12 ધરાવતા મૅગ્નેશિયમ તત્ત્વની અને પરમાણ્વીય ક્રમાંક 16 ધરાવતા સલ્ફર તત્ત્વની સંયોજકતા કેટલી છે?
ઉત્તર: પરમાણ્વીય ક્રમાંક 12 ધરાવતા Mg તત્ત્વની
∴ Mgની સંયોજકતા = 2
- પરમાણ્વીય ક્રમાંક 16 ધરાવતા આ તત્ત્વની

∴ Sની સંયોજકતા = 8 – 6 = 2
પ્રશ્ન 3. પ્રથમ વીસ તત્ત્વોની સંયોજકતાઓ શોધો.
ઉત્તર :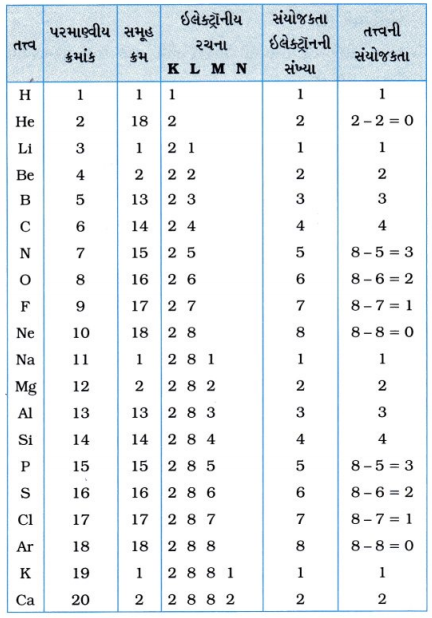
પ્રશ્ન 4. આવર્તમાં ડાબીથી જમણી તરફ જતાં સંયોજકતા કેવી રીતે બદલાય છે?
ઉત્તર: આવર્તમાં ડાબીથી જમણી તરફ જતાં સંયોજકતા શરૂઆતમાં વધે છે, ત્યારબાદ ઘટે છે.
- આવર્તમાં ડાબી બાજુથી જમણી બાજુ તરફ જતાં સંયોજકતા પહેલાં 1થી 4 અને પછી 4થી 6 થાય છે.
પ્રશ્ન 5. સમૂહમાં ઉપરથી નીચે તરફ જતાં સંયોજકતા કેવી રીતે બદલાય છે?
ઉત્તર: સમૂહમાં ઉપરથી નીચે તરફ જતાં સંયોજક્તા બદલાતી નથી, અચળ જ રહે છે.
પ્રવૃત્તિ 5.7 [પા.પુ. પાના નં. 88]
પ્રશ્ન 1. નીચે બીજા આવર્તનાં તત્ત્વોની પરમાણ્વીય ત્રિજ્યા આપેલી છે:
તેમને પરમાણ્વીય ત્રિજ્યાના ઊતરતા ક્રમમાં ગોઠવો.
ઉત્તર: પરમાણ્વીય ત્રિજ્યાનો ઊતરતો ક્રમ :
પ્રશ્ન 2. શું હવે તત્ત્વો આવર્ત કોષ્ટકમાં આપેલ આવર્તની ભાતમાં ગોઠવાયેલ છે?
ઉત્તર: આપેલાં તત્ત્વો આવર્ત કોષ્ટકમાં બીજા આવર્તની ભાતમાં ગોઠવાયેલાં છે.
પ્રશ્ન 3. કયાં તત્ત્વો સૌથી મોટા પરમાણુ અને સૌથી નાના પરમાણુ ધરાવે છે?
ઉત્તર: સૌથી મોટા પરમાણુ ધરાવતું તત્ત્વ લિથિયમ (Li), જ્યારે સૌથી નાના પરમાણુ ધરાવતું તત્ત્વ ઑક્સિજન (O) છે.
પ્રશ્ન 4. આવર્તમાં ડાબીથી જમણી તરફ જતાં પરમાણ્વીય ત્રિજ્યામાં શો ફેરફાર થાય છે?
ઉત્તર: આવર્તમાં ડાબીથી જમણી તરફ જતાં પરમાણ્વીય ત્રિજ્યા ઘટે છે.
પ્રવૃત્તિ 5.8 [પા.પુ. પાના નં. 89]
પ્રશ્ન 1. નીચે આપેલ પ્રથમ સમૂહનાં તત્ત્વોની પરમાણ્વીય ત્રિજ્યામાં ફેરફારનો અભ્યાસ કરો અને તેમને ચડતા ક્રમમાં ગોઠવો :
ઉત્તર: પરમાણ્વીય ત્રિજ્યાનો ચડતો ક્રમ:
પ્રશ્ન 2. એવાં તત્ત્વોનાં નામ આપો જે સૌથી મોટા અને સૌથી નાના પરમાણુ ધરાવતા હોય?
ઉત્તર: સૌથી મોટા પરમાણુ ધરાવતું તત્ત્વ સીઝિયમ (Cs), જ્યારે સૌથી નાના પરમાણુ ધરાવતું તત્ત્વ લિથિયમ (LI) છે.
પ્રશ્ન 3. સમૂહમાં ઉપરથી નીચે તરફ જતાં પરમાણ્વીય કદમાં કેવી રીતે ફેરફાર થાય છે?
ઉત્તર: સમૂહમાં ઉપરથી નીચે તરફ જતાં પરમાણ્વીય કદ વધે છે.
પ્રવૃત્તિ 5.9 [પા.પુ. પાના નં. 89]
પ્રશ્ન 1. ત્રીજા આવર્તનાં તત્ત્વો તપાસો અને તેમને ધાતુઓ તેમજ અધાતુઓ સ્વરૂપે વર્ગીકૃત કરો.
ઉત્તર: ત્રીજા આવર્તનાં તત્ત્વો :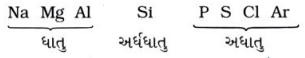
પ્રશ્ન 2. આવર્ત કોષ્ટકની કઈ તરફ ધાતુઓ જોવા મળે છે?
ઉત્તર: આવર્ત કોષ્ટકની ડાબી બાજુએ ધાતુઓ જોવા મળે છે.
પ્રશ્ન 3. આવર્ત કોષ્ટકની કઈ તરફ અધાતુઓ જોવા મળે છે?
ઉત્તર: આવર્ત કોષ્ટકની જમણી બાજુએ અધાતુઓ જોવા મળે છે.
પ્રવૃત્તિ 5.10 [પા.પુ. પાના નં. 89]
પ્રશ્ન 1. તમારા મત મુજબ સમૂહમાં ઇલેક્ટ્રૉન ગુમાવવાની વૃત્તિ કેવી રીતે બદલાય છે?
ઉત્તર: સમૂહમાં ઉપરથી નીચે તરફ જતાં ઇલેક્ટ્રૉન ગુમાવવાની વૃત્તિ વધે છે.
પ્રશ્ન 2. આવર્તમાં આ વૃત્તિ કેવી રીતે બદલાય છે?
ઉત્તર: આવર્તમાં ડાબીથી જમણી તરફ જતાં ઇલેક્ટ્રૉન ગુમાવવાની વૃત્તિ ઘટે છે.
પ્રવૃત્તિ 5.11 [પા.પુ. પાના નં. 90]
પ્રશ્ન 1. આવર્તમાં ડાબીથી જમણી તરફ જતાં ઇલેક્ટ્રોન સ્વીકારવાની આ વૃત્તિ કેવી રીતે બદલાશે?
ઉત્તર: આવર્તમાં ડાબીથી જમણી તરફ જતાં ઇલેક્ટ્રૉન સ્વીકારવાની વૃત્તિ વધશે.
પ્રશ્ન 2. સમૂહમાં ઉપરથી નીચે તરફ જતાં ઇલેક્ટ્રૉન સ્વીકારવાની વૃત્તિ કેવી રીતે બદલાશે?
ઉત્તર: સમૂહમાં ઉપરથી નીચે તરફ જતાં ઇલેક્ટ્રૉન સ્વીકારવાની વૃત્તિ ઘટશે.
Class 10 Science Notes Chapter 5 તત્ત્વોનું આવર્તી વર્ગીકરણ
તત્ત્વોનું આવર્તી વર્ગીકરણ Class 10 Notes
→ આધુનિક સમયમાં 118 તત્ત્વો જાણીતાં છે, તે પૈકી 94 તત્ત્વો કુદરતી રીતે પ્રાપ્ય છે.
→ તત્ત્વોનું વર્ગીકરણ તેમના ગુણધર્મોની સમાનતાના આધારે કરવામાં આવ્યું છે.
→ તત્ત્વોના વર્ગીકરણનો પ્રયાસ ડોબરેનર, ન્યુલૅન્ડ, મેન્ડેલીફ, લોથર મેયર અને હેન્રી મોસલેએ કર્યો હતો.
→ ડોબરેનરની ત્રિપુટીનો નિયમ (Law of Dohereiner’s triads) : ત્રિપુટીનાં ત્રણ તત્ત્વોને તેમના પરમાણ્વીય દળના ચડતા ક્રમમાં ગોઠવતાં મધ્યમાં રહેલા તત્ત્વનું પરમાણ્વીય દળ અન્ય બે તત્ત્વોના પરમાણ્વીય દળના લગભગ સરેરાશ જેટલું હોય છે.
→ ચુલૅન્ડનો અષ્ટકનો નિયમ (Newland’s law of octaves) : તત્ત્વોને જ્યારે તેમનાં પરમાણ્વીય દળના ચડતા ક્રમમાં ગોઠવવામાં આવે ત્યારે કોઈ એક તત્ત્વથી આઠમા ક્રમે આવતું તત્ત્વ સમાન ગુણધર્મો ધરાવે છે.
→ મેન્ડેલીફનો આવર્ત નિયમ (Mendeleev’s Periodic law) : તત્ત્વોના ગુણધર્મો તેમના પરમાણ્વીય દળના આવર્તનીય વિધેય છે.
→ મેન્ડેલીફે તત્ત્વોનું વર્ગીકરણ ઊભા સ્તંભ કે જેને સમૂહ તથા આડી હરોળ કે જેને આવર્ત કહે છે, એમ બે પ્રકારે કર્યું હતું.
→ મેન્ડેલીફે સ્ટેડિયમ (SC), ગેલિયમ (Ga) અને જર્મેનિયમ(Ge)ને અનુક્રમે એકા-બોરોન, એકા-ઍલ્યુમિનિયમ અને એકા-સિલિકોન તરીકે ઓળખાવ્યા હતા.
→ સમસ્થાનિક (Isotopes) : એક જ તત્ત્વના જુદા જુદા પરમાણુઓ કે જેમના પરમાણ્વીય ક્રમાંક સમાન, પરંતુ પરમાણ્વીય દળ અસમાન હોય, તેવાં તત્ત્વોને એકબીજાના સમસ્થાનિકો કહે છે.
→ હેન્રી મોસેલે દર્શાવ્યું કે તત્ત્વના પરમાણ્વીય દળની સરખામણીમાં તેનો પરમાણ્વીય ક્રમાંક વધુ આધારભૂત ગુણધર્મ છે.
→ આધુનિક આવર્ત નિયમ (The modern periodic law) : તત્ત્વોના ગુણધર્મો તેમના પરમાણ્વીય ક્રમાંકના આવર્તનીય વિધેય છે.
→ આધુનિક આવર્ત કોષ્ટકમાં તત્ત્વોનું વર્ગીકરણ 18 સમૂહ અને 7 આવર્તમાં કરવામાં આવ્યું છે.
| આવર્ત ક્રમ | તત્ત્વની સંખ્યા |
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
| 4 | 18 |
| 5 | 18 |
| 6 | 32 |
| 7 | અધૂરો આવર્ત |
→ કોઈ પણ કક્ષામાં ઇલેક્ટ્રૉનની મહત્તમ સંખ્યા = 2n જ્યાં, n = કેન્દ્રથી આપેલ કક્ષાનો ક્રમ
→ આવર્ત કોષ્ટકમાં જે-તે તત્ત્વનું સ્થાન તેની રાસાયણિક ક્રિયાશીલતા વિશે માહિતી આપે છે.
→ આવર્તનીય ગુણધર્મો (Periodic properties) તત્ત્વોના જે ગુણધર્મો તત્ત્વની ઇલેક્ટ્રૉનીય રચના પર આધાર રાખે છે, તેવા ગુણધર્મોને આવર્તનીય ગુણધર્મો કહે છે.
→ સંયોજકતા (Valency) તત્ત્વની સંયોજકતા તેના પરમાણુની બાહ્યતમ કક્ષામાં રહેલા સંયોજકતા ઇલેક્ટ્રૉનની સંખ્યા દ્વારા નક્કી થાય છે. અથવા કોઈ પણ તત્ત્વની અન્ય તત્ત્વ સાથે સંયોજાવાની સાપેક્ષ ક્ષમતાને સંયોજકતા કહે છે.
→ આવર્તમાં તત્ત્વની સંયોજકતા પ્રથમ વધે (1થી 4) ત્યારબાદ ઘટે (4થી ) છે. જ્યારે કોઈ એક જ સમૂહનાં બધાં જ તત્ત્વોની સંયોજકતા નિશ્ચિત જ રહે છે.
→ પરમાણ્વીય કદ – Atomic size (પરમાણ્વીય ત્રિજ્યા – Atomic radius) એક સ્વતંત્ર પરમાણુના કેન્દ્રથી તેની સૌથી બહારની કક્ષા વચ્ચેના સરેરાશ અંતરને પરમાણ્વીય કદ (પરમાણ્વીય ત્રિજ્યા) કહે છે.
→ કોઈ પણ આવર્તમાં ડાબી બાજુથી જમણી બાજુ તરફ જતાં પરમાણ્વીય ત્રિજ્યા ઘટવાનું, જ્યારે સમૂહમાં ઉપરથી નીચે તરફ જતાં પરમાણ્વીય ત્રિજ્યા વધવાનું વલણ ધરાવે છે.
→ આવર્ત કોષ્ટકમાં ધાતુ તત્ત્વો ડાબી બાજુએ, અધાતુ તત્ત્વો જમણી બાજુએ અને અર્ધધાતુ (મેટેલોઇડ) તત્ત્વો મધ્યમાં વર્ગીકૃત કર્યા છે.
→ આધુનિક આવર્ત કોષ્ટકમાં બોરોન (B), સિલિકોન (Si), જર્મેનિયમ (Ge), આર્સેનિક (As), ઍન્ટિમની Sb), ટેલ્યુરિયમ (Te) અને પોલોનિયમ (Po) મધ્યવર્તી ગુણધર્મો ધરાવે છે, તેમને મેટેલોઇડ અથવા અર્ધધાતુ તત્ત્વો કહે છે.
→ ધાતુ તત્ત્વો સ્વભાવે વિદ્યુત ધન, જ્યારે અધાતુ તત્ત્વો વિદ્યુત ત્રણ છે.
→ સામાન્ય રીતે અધાતુ તત્ત્વોના ઑક્સાઇડ ઍસિડિક, જ્યારે ધાતુ – તત્ત્વોના ઑક્સાઇડ બેઝિક હોય છે.
→ પરમાણ્વીય ક્રમાંક (Atomic number) (Z) : પરમાણુના કેન્દ્રમાં રહેલા પ્રોટોનની સંખ્યાને પરમાણ્વીય ક્રમાંક કહે છે.


