Chapter 1: Matter in Our Surroundings – Short Notes
1. Introduction to Matter
- Matter is anything that has mass and occupies space.
- It is made up of tiny particles that are constantly moving.
2. Physical Nature of Matter
- Matter is made up of particles: These particles are very, very small.
- Particles have space between them: This is why gases can be compressed and why one substance can dissolve in another (diffusion).
- Particles are constantly moving: They possess kinetic energy. The kinetic energy increases with temperature.
- Particles attract each other: The force of attraction keeps the particles together. This force is strongest in solids and weakest in gases.
3. States of Matter
Matter exists in three states: Solid, Liquid, and Gas.
| Property | Solid | Liquid | Gas |
|---|---|---|---|
| Shape & Volume | Fixed shape and volume | Fixed volume, no fixed shape | No fixed shape or volume |
| Density | High | Moderate (less than solid) | Very Low |
| Compressibility | Negligible | Very Low | High |
| Fluidity (Flow) | Cannot flow | Can flow | Can flow easily |
| Inter-particle Forces | Strongest | Weaker than solids | Negligible |
| Kinetic Energy of Particles | Lowest | Higher than solids | Highest |
| Diffusion | Very slow | Faster than solids | Very fast |
4. Change of State
A substance can change its state by altering temperature or pressure.
- Melting (Fusion): Solid to Liquid. The temperature at which this happens is the Melting Point.
- Freezing (Solidification): Liquid to Solid. The temperature is the Freezing Point (same as melting point).
- Boiling (Vaporization): Liquid to Gas. The temperature at which this happens is the Boiling Point.
- Condensation: Gas to Liquid.
- Sublimation: Solid directly to Gas without becoming liquid (e.g., Camphor, Ammonium chloride, Naphthalene balls, Dry Ice).
5. Latent Heat
- The hidden heat absorbed or released by a substance during a change of state without a change in temperature.
- Latent Heat of Fusion: Heat required to change 1 kg of solid into liquid at its melting point.
- Latent Heat of Vaporization: Heat required to change 1 kg of liquid into vapour at its boiling point.
6. Evaporation
- The process of a liquid changing into vapour below its boiling point and from its surface.
- Factors affecting Evaporation:
- Surface Area: Increases with an increase in surface area.
- Temperature: Increases with an increase in temperature.
- Humidity: Decreases with an increase in humidity.
- Wind Speed: Increases with an increase in wind speed.
- Cooling Effect of Evaporation: When a liquid evaporates, the particles with the highest kinetic energy escape first, lowering the average kinetic energy (temperature) of the remaining particles. This causes cooling.
- Example: We feel cool when sweat evaporates from our skin.
Important Questions & Answers
Very Short Answer Type Questions (1 Mark)
1. Define matter.
Ans: Anything that has mass and occupies space is called matter.
2. Name the process by which a drop of ink spreads in a beaker of water.
Ans: Diffusion.
3. What is the physical state of water at: a) 25°C b) 0°C c) 100°C?
Ans: a) Liquid, b) Solid (Ice) or liquid, c) Gas (Steam) or liquid.
4. What is the SI unit of temperature?
Ans: Kelvin (K).
5. What is the boiling point of water at one atmospheric pressure?
Ans: 100°C (373 K).
6. Why do we see water droplets on the outer surface of a glass containing ice-cold water?
Ans: The water vapour present in the air comes in contact with the cold outer surface of the glass, loses energy, and condenses into liquid water droplets.
7. What is the common name of the process where a solid directly changes into a gas?
Ans: Sublimation.
Short Answer Type Questions (2-3 Marks)
1. Why does the temperature remain constant during the melting of ice?
Ans: The temperature remains constant during melting because the heat energy supplied is used to overcome the forces of attraction between the particles of ice (latent heat of fusion). This energy breaks the rigid structure of the solid into a liquid without increasing the kinetic energy (and hence the temperature).
2. How does evaporation cause cooling?
Ans: During evaporation, the particles of the liquid absorb energy from the surroundings to overcome the force of attraction and change into vapour. The particles that leave the surface of the liquid are the ones with higher kinetic energy. The loss of these high-energy particles lowers the average kinetic energy of the remaining particles, thus lowering the temperature and causing cooling.
3. Why do gases have high compressibility but not solids?
Ans: Gases have very large inter-particle spaces. When pressure is applied, these particles can be forced closer together, reducing the volume. In solids, the particles are tightly packed with very little space between them, making them incompressible.
4. Why do we wear cotton clothes in summer?
Ans: Cotton is a good absorber of water (sweat). During summer, we sweat more. The sweat is absorbed by the cotton cloth and spreads over a large surface area, leading to faster evaporation. This evaporation causes cooling, making us feel comfortable.
5. Convert the following temperatures to the Kelvin scale: a) 25°C b) 373°C
Ans: To convert °C to K, we use the formula: K = °C + 273
a) 25°C = 25 + 273 = 298 K
b) 373°C = 373 + 273 = 646 K
Long Answer Type Questions (5 Marks)
1. Compare the properties of solids, liquids, and gases.
Ans: (Refer to the table in the short notes section for a detailed answer). Mention properties like shape, volume, density, compressibility, fluidity, inter-particle forces, and kinetic energy.
2. a) What is latent heat? Differentiate between latent heat of fusion and latent heat of vaporization.
b) How can you show that water vapour is present in the air?
Ans:
a) Latent Heat: The heat energy required to change the state of a substance without a change in temperature is called latent heat.
- Latent Heat of Fusion: Heat energy required to change 1 kg of a solid into liquid at atmospheric pressure at its melting point.
- Latent Heat of Vaporization: Heat energy required to change 1 kg of a liquid into vapour at atmospheric pressure at its boiling point.
b) Take a glass full of ice-cold water and leave it on a table. After some time, we will observe water droplets on the outer surface of the glass. This happens because the water vapour present in the air comes in contact with the cold surface of the glass, loses energy, and gets converted to liquid water (condensation). This proves the presence of water vapour in the air.
3. Describe an activity to show that the rate of evaporation increases with an increase in surface area.
Ans:
- Aim: To show the effect of surface area on evaporation.
- Materials: Two Petri dishes/plates, same volume of water.
- Procedure:
- Take two Petri dishes. Label them A and B.
- Pour 10 ml of water in dish A and 10 ml of water in dish B.
- Leave dish A as it is (small surface area). Spread the water from dish B with a spoon to create a larger surface area.
- Leave both dishes in the same place for some time.
- Observation: The water in dish B (with a larger surface area) will evaporate completely faster than the water in dish A.
- Conclusion: The rate of evaporation increases with an increase in surface area.
Matter in Our Surroundings InText Questions and Answers
Page – 3
Question 1.
Which of the following are matter? Chair, air, love, smell, hate, almonds, thought, cold, cold drink, smell of perfume.
Answer:
Anything that occupies space and has mass is called matter. Matter can exist in three physical states – solid, liquid and gas.
- Solid state → Chair and almond
- Liquid state → Cold drink
- Gaseous state → Air and smell of perfume.
Note: The sense of smell is not matter. However, the smell or odour of a substance is classified as matter. The smell of any substance (say, perfume) is the gaseous form of that substance which our olfactory system can detect (even of very low concentrations). Hence, smell of perfume is matter.
Question 2.
Give reasons for the following observations. The smell of hot sizzling food reaches you several metres away, but to get the smell from the cold food you have to go close.
Answer:
The particles of matter possess kinetic energy and thus are constantly moving. At low temperatures, the kinetic energy is low and hence the particles move slowly. But as the temperature rises, the kinetic energy increases accordingly and hence the particles move faster.
Now since the particles of hot vapours coming out of hot sizzling food move faster, therefore, they easily reach you even when you are several metres away. On the other hand, the particles of vapours coming out of cold food travel only slowly and hence do not reach you. Therefore, to get the smell from cold food you have to go close to the food.
Question 3.
A diver is able to cut through water in a swimming pool. Which property of matter does this observation show?
Answer:
The ability of a diver to cut through water in a swimming pool shows that matter is made up of particles.
Question 4.
What are the characteristics of particles of matter?
Answer:
The characteristics of particles of matter are:
- Particles of matter have spaces between them.
- Particles of matter are continuously moving.
- Particles of matter attract each other.
Page – 6
Question 5.
The mass per unit volume of a substance is called density (density = mass/volume). Arrange the following in order of increasing density: air, exhaust from chimneys, honey, water, chalk, cotton and iron.
Answer:
The given substances in the increasing order of their densities can be represented as:
Air < exhaust from chimney < cotton < water < honey < chalk < iron
Question 6.
(a) Tabulate the difference in characteristics of states of matter.
(b) Comment upon the following: rigidity, compressibility, fluidity, filling a gas container, shape, kinetic energy and density
Answer:
(a)
States of Matter
Solid State
- Has a definite shape and volume.
- Incompressible.
- Particles attract each other very strongly.
- Particles cannot move freely.
Liquid State
- No definite shape; takes the shape of the container.
- Slightly compressible.
- Force of attraction between particles is less than in solids.
- Particles move freely but remain within a boundary.
Gaseous State
- Neither definite shape nor definite volume.
- Highly compressible.
- Force of attraction between particles is the least.
- Particles move freely in all directions.
(b) Rigidity: It is the property due to which an object retains its shape and size. Solids are rigid while liquids and gases are not.
Compressibility: It is the property due to which a substance is reduced to a smaller volume when force is applied on it. Game’s are highly compressible while solids and liquids are not.
Fluidity: It is the property due to which a substance tends to flow. Gases and liquids can flow, hence they are known as fluids.
Filling a gas container: Particles of a gas move freely in all the directions and occupy all the space available to them. Hence, gas fills a container completely.
Shape: The structure of an object is called its shape. Solids have a definite shape while gases and liquids do not.
Kinetic energy: The energy of the particles of matter due to their movement is called their kinetic energy. Gases have maximum kinetic energy among the three states of matter. Kinetic energy in-creases with the rise in temperature and vice-versa.
Density: The mass per unit volume of a substance is called its density.
Density Formula
Density (d) = Mass (m) / Volume (v)
This formula shows that the density of a substance is calculated by dividing its mass by its volume.
- d = Density
- m = Mass
- v = Volume
Unit of density are kg m 3 or g cm 3. Generally, a substance has maximum density in its solid state as compared to liquid or gaseous state.
Question 7.
Give reasons:
(a) A gas fills completely the vessel in which it is kept.
(b) A gas exerts pressure on the walls of the container.
(c) A wooden table should be called a solid.
(d) We can easily move our hand in air but to do the same through a solid block of wood, we need a karate expert.
Answer:
(a) The particles of a gas are constantly moving in all the directions with different speeds. Therefore, they do not have a fixed volume and hence completely fill the vessel in which they are kept.
(b) The particles of a gas are constantly moving in all directions with different speeds. As a result of this random motion, the particles of a gas collide with one another and also against the walls of the container. As a result of these collisions, the gas exerts some force on the walls of the container. This force per unit area is called pressure of the gas. Thus, gases exert pressure due to the collisions of the particles of the gas on the walls of the
containing vessel.
(c) A wooden table has a definite shape, distinct boundaries and a fixed volume, therefore, it should be called a solid.
(d) We can easily move our hand in air since the forces of attraction between the particles of a gas, i.e., air are very weak and hence can be easily overcome for the movement of the hand. In contrast, the particles of a solid are closely packed and hence the interparticle forces of attraction are very strong. As a result, they cannot be easily overcome for movement of the hand. In other words, we need a karate expert with almost incredible power to separate these particles.
Question 8.
Liquids generally have lower density as compared to solids. But you must have observed that ice floats on water. Find out why?
Answer:
The mass per unit volume of a substance is called density (density = mass/volume). As the volume of a substance increases, its density decreases. Though ice is a solid, it has large number of empty spaces between its particles. These spaces are larger as compared to the spaces present between the particles of water. Thus, the volume of ice is greater than that of water. Hence, the density of ice is less than that of water. A substance with lower density than water can float on water. Therefore, ice floats on water.
Page – 9
Question 9.
Convert the following temperatures to the Celsius scale:
(a) 300 K
(b) 573 K.
Answer:
(a) 300 K = (300 – 273)°C
= 27°C
(b) 573 K = (573 – 273)°C
= 300°C
Question 10.
What is the physical state of water at:
(a) 250°C
(b) 100°C
Answer:
(a) Water at 250°C exists in gaseous state.
(b) At 100°C, the boiling point of water, water exists both as a liquid as well as a gas.
Question 11.
For any substance, why does the temperature remain constant during the change of state?
Answer:
During a change of state, the temperature remains constant. This is because all the heat supplied to increase the temperature is utilised in changing the state by overcoming the forces of attraction between the particles. Therefore, this heat does not contribute in increasing the temperature of the substance.
Question 12.
Suggest a method to liquefy atmospheric gases.
Answer:
The gases can be converted into liquids by bringing its particle closer, so atmospheric gases can be liquefied either by decreasing temperature or by increasing pressure.
Page – 10
Question 13.
Why does a desert cooler cool better on a hot dry day?
Answer:
A desert cooler increases the humidity of the surrounding air. The water particles in the air take the heat from the surrounding objects and evaporates. In hot and dry days, the moisture level is very low in the atmosphere which increases the rate of evaporation. Because of faster evaporation, the cooler works well. That’s why a desert cooler cools better on a hot dry day.
Question 14.
How does the water kept in an earthen pot (matha) become cool during summer?
Answer:
There are some pores in an earthen pot through which the liquid inside the pot evaporates. The heat required for evaporation is taken from the water in the pot. This makes the water inside the pot cool. In this way, water kept in an earthen pot becomes cool during summer.
Question 15.
Why does our palm feel cold when we put some acetone or petrol or perfume on it?
Answer:
Acetone, petrol and perfume evaporate at low temperatures. When some acetone, petrol or perfume is dropped on the palm, it takes heat from the palm and evaporates thereby making the palm cooler.
Question 16.
Why are we able to sip hot tea or milk faster from a saucer rather than a cup?
Answer:
A liquid has a larger surface area in a saucer than in a cup. Thus, the liquid evaporates faster and cools faster in a saucer than in a cup. For this reason, we are able to sip hot tea or milk faster from a saucer than a cup.
In-Text Activities Solved
( Textbook Page 1)
Activity 1.1
Answer:
Observation: common salt/ sugar is added to water, the particles of salt/sugar get into the empty spaces between particles of water. The salt will dissolve in water. There will be no change in the level of the solution by the addition of small amount.
Conclusion: This experiment indicates that there are some vacant spaces among the particles of water and the particles of salt occupies these spaces. The particles of matter have spaces between them, as a result.
(Textbook Page 1)
Activity 1.2
Answer:
Observation: A crystal of potassium permanganate contains millions of tiny particles which keep on dividing by addition of solvent / water, hence the dark purple colour of the potassium permanganate solution will somewhat decrease.
Conclusion: When this experiment is repeated 5-8 times, the purple colour of the potassium permanganate solution will not disappear completely. Some colour will always persist even when the solution is very dilute. Matter is made up of very small particles which cannot be observed under a powerful microscope.
(Textbook Page 2)
Activity 1.3
Answer:
Observation: In order to feel the smell of incense stick, we need to go near them. When the incense stick is lighted, the fragrance will immediately spread. Because as the temperature rises the kinetic energy of the incense particles increases. Hence, particles of incense more rapidly and thus intermix with the particles of the air rapidly. Yes we will get the smell sitting at a distance.
Conclusion: It can be concluded that particles of matter are always in motion. The movement of the particles is slow in case of unbumt incense stick. On the other hand, the movement of particles of matter is very fast when you supply heat energy by burning the incense stick.
(Textbook Page 2)
Activity 1.4
Answer:
Observation: Due to weak attraction forces between the particles of ink the colour of the blue or red ink spreads throughout the water in the beaker immediately. The drop of honey also spreads but takes much more time than ink due to strong inter molecular forces. The total time taken by the drop of ink to spread evenly throughout the water is much move less than that of honey.
Conclusion: Thus, we can conclude that particles of liquid diffuse on its own because they are constantly in motion. However, the rate of diffusion of two different liquid particles may vary and depends upon the strength of forces. Stronger the forces of attraction lower is the average speed.
(Textbook Page 2)
Activity 1.5
Answer:
Observation: As the time passes, the water turns into purple colour solution in both the beakers because the particles of water and potassium permanganate get evenly mixed by the process of diffusion. But the water contained in the hot beaker turns into a purple colour solution at a faster rate as compared to water contained in the cold beaker. Yes, the rate of mixing changes with temperature. This is because, in hot water the particles of water and that of potassium permanganate have more kinetic energy and therefore move faster. Hence, they mix with each other more quickly.
Class 7 Solutions
Conclusion: This shows that particles of matter are constantly moving and their rate of diffusion into liquid varies with temperature.
(Textbook Page 3)
Activity 1.6
Answer:
Observation: The third group is easiest to break. This is because; in third group the students from chain by touching each other with only their fingertips. The group in which the particles hold each other with maximum force is first group, hence such human chain was most difficult break.
Conclusion: This shows that particles of matter which are held with each other with maximum force of attraction cannot separated easily.
(Textbook Page 3)
Activity 1.7
Answer:
Observation: It is very easy to break the piece of chalk into smaller particles due to weakest forces of attraction. On the other hand, the iron ball does not break even with a large force due to strong forces of attraction.
Conclusion: This shows that the force of attraction between the particles of chalk is quite weak; whereas the force of attraction between the particles of iron ball is very strong.
(textbook Page 3)
Activity 1.8
Answer:
Observation: Yes, this shows that the interparticle attraction between particles of water (liquid state) is not very strong. The stream of water remains together because the particles of matter attract each other to form uniform layers.
Conclusion: This exhibit that particles of water have force acting between them which keeps them together. However, the strength of this force is not very strong.
(Textbook Page 4)
Activity 1.9
Answer:
Observation: Yes, all these articles have a definite shapes, distinct boundaries and a fixed volume. Pen will break, there will be no effect on book and thread and after long time needle will break. No, the articles are not capable of diffusing into each other. No, the articles do not get compressed.
Class 7 Solutions
Conclusion: Thus, we can conclude that solid articles have a definite shape, distinct boundaries and a fixed volume. They are rigid and non – compressible i.e., they may break under force but their shape cannot be changed.
(Textbook Page 4)
Activity 1.10
Answer:
Observation: All these liquids will flow when spilt on the floor. Volume of the liquid remains same i.e. 50 mL when it is transferred from one container to the other. The shape of a liquid is not fixed. It takes up the shape of the container in which it is put. Further, when the liquid is poured from one container to the other, it flows.
Conclusion: Thus, we can’conclude that liquids do not have a fixed shape but have a fixed volume, i.e., they take up the shape of the container in which they are poured but their volume does not change on changing the shape of the container. Liquids flow and hence they can be called as fluids.
(Textbook Page 5)
Activity 1.11
Answer:
Observation: The pistons of the syringes (containing chalk pieces and water) require a large amount of force, while the piston of the third syringe which contains air is comparatively easier to push.
Conclusion: Thus, we can conclude that a solid and a liquid does not get compressed on applying pressure, but a gas can be compressed easily by applying pressure. Therefore, gases are highly compressible liquids are almost incompressible while solids are completely incompressible.
(Textbook Page 6)
Activity 1.12
Answer:
Observation: On increasing the temperature of solids, the kinetic energy of the particles increases. Due to the increase in kinetic energy, the particles start vibrating with greater speed. Hence, heat energy supplied is used up in overcoming the forces of attraction between the liquid water particles to change them from liquid water to steam.
Class 7 Solutions
Conclusion: The energy supplied by heat overcomes the forces of attraction between the particles. The particles leave their fixed positions and start moving more freely. A stage is reached when the solid melts and is converted in a liquid. This stage is called as the melting point of the solid.
(Textbook Page 8)
Activity 1.13
Answer:
Observation: The solid ammonium chloride does not melt on heating. It is directly converted into vapours and gets deposited on the inner wall of the funnel as crystalline solid on coming in contact with the cold inner walls of the funnel.
Conclusion: A change of state directly from solid to gas without changing into liquid state or vice versa is called sublimation.
(Textbook Page 9)
Activity 1.14
Answer:
Observation: The surface area of water exposed to the atmosphere is minimum in case of a test tube, therefore, it takes a long time (2/3 days) for 5 mL of water to evaporate. Although the surface area of 5 ml. of water taken in two open china dishes is the same, yet water in the china dish placed near the window or under the fan evaporates more quickly than the water in the china dish placed inside a cupboard or on a shelf in your class room. All the three steps of activity will take longer time on a rainy day since the humidity is high.
Class 7 Solutions
Conclusion: Evaporation is a surface phenomena and so, when the surface area of the liquid is greater, the rate of evaporation will be more. The rate of evaporation of a liquid decreases with increase in the humidity of air and it increases with increase in the speed of the wind. Let us now differentiate evaporation and boiling.
Matter in Our Surroundings Textbook Questions and Answers
Question 1.
Convert the following temperatures to the Celsius scale:
(a) 300 K
(b) 573K
Answer:
(a) 300 K = (300 – 273)°C
= 27°C
(b) 573 K = (573 – 273)°C
=300°C
Board Exam Guides
Class 7 Solutions
Question 2.
Convert the following temperatures to the Kelvin scale:
(a) 25°C
(b) 373°C
Answer:
(a) 25°C = (25 + 273) K
= 298 K
(b) 373°C = (373 + 273) K
= 646 K
Question 3.
Give reasons for the following observations:
(а) Naphthalene balls disappear with time without leaving any solid,
(b) We can get the smell of perfume sitting several metres away.
Answer:
(a) Naphthalene shows the property of sublimation. Evaporation of naphthalene takes place easily and so it disappears in the course of time without leaving a solid.
(b) Perfume vapourises very fast and its vapours diffuse into air easily. That is why we can smell perfume sitting several metres away.
Question 4.
Arrange the following substances in increasing order of forces of attraction between the particles: water, sugar, oxygen.
Answer:
Sugar is a solid, the forces of attraction between the particles of sugar are strong. Water is a liquid, the forces of attraction here are weaker than sugar. Oxygen is a gas, the forces of attraction are the weakest in gases. Thus, the increasing order of forces of attraction between the particles of water, sugar and oxygen is – Oxygen < Water < Sugar.
Question 5.
What is the physical state of water at:
(a) 25°C
(b) 0°C
(c) 100°C
Answer:
(а) At 25°C, the physical state of water is liquid.
(b) At 0°C, the physical state of water can be either a solid (ice) or a liquid.
(c) At 100°C, the physical state of water can be either a liquid or a gas (steam).
Question 6.
Give two reasons to justify –
(а) Water at room temperature is a liquid.
(b) An iron almirah is a solid at room temperature.
Answer:
(a) At room temperature (25°C), water is a liquid because it has the following characteristic of liquid:
- At room temperature, water has no shape but has a fixed volume that is, it occupies the shape of the container in which it is kept.
- At room temperature, water flows.
(b) An iron almirah is a solid at room temperature (25°C) because:
- It has a definite shape and volume like a solid at room temperature.
- It is rigid as solid at room temperature.
Question 7.
Why is ice at 273 K more effective in cooling than water at the same temperature?
Answer:
Ice at 273 K has less energy than water (although both are at the same temperature). Water possesses the additional latent heat of fusion. Hence, at 273 K, ice is more effective in cooling than water.
Question 8.
What produces more severe burns, boiling water or steam?
Answer:
Steam produces more severe burns than boiling water. This is because steam has more energy than boiling water, present in it in the form of latent heat of vapourisation,
Question 9.
Name A, B, C, D, E and F in the following diagram showing change in its state.
Answer:
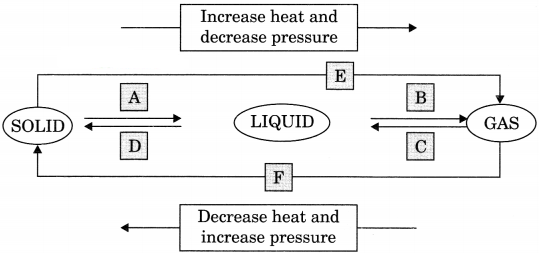
A → Melting/Fusion
B → Boiling/Vapourisation
C → Condensation
D → Soldification
E → Sublimation
F → SublimationPost navigation
अध्याय 1: हमारे आस-पास के पदार्थ – संक्षिप्त नोट्स (Short Notes)
1. पदार्थ का परिचय
- पदार्थ वह है जिसमें द्रव्यमान होता है और स्थान घेरता है।
- यह छोटे-छोटे कणों से मिलकर बना होता है जो लगातार गति करते रहते हैं।
2. पदार्थ की भौतिक प्रकृति
- पदार्थ कणों से बना है: ये कण अत्यंत सूक्ष्म होते हैं।
- कणों के बीच रिक्त स्थान होता है: इसीलिए गैसों को संपीडित किया जा सकता है और विसरण (diffusion) होता है।
- कण निरंतर गतिशील रहते हैं: उनमें गतिज ऊर्जा होती है, जो तापमान बढ़ने पर बढ़ती है।
- कण एक-दूसरे को आकर्षित करते हैं: यह आकर्षण बल कणों को एक साथ बनाए रखता है। यह बल ठोस में सबसे प्रबल और गैस में सबसे दुर्बल होता है।
3. द्रव्य की अवस्थाएँ
पदार्थ तीन अवस्थाओं में पाया जाता है: ठोस, द्रव और गैस।
| गुण | ठोस | द्रव | गैस |
|---|---|---|---|
| आकार एवं आयतन | निश्चित आकार और आयतन | निश्चित आयतन, अनिश्चित आकार | अनिश्चित आकार और आयतन |
| घनत्व | उच्च | मध्यम (ठोस से कम) | अत्यंत निम्न |
| संपीड्यता | नगण्य | बहुत कम | उच्च |
| प्रवाहित होने की क्षमता | प्रवाहित नहीं हो सकते | प्रवाहित हो सकते हैं | आसानी से प्रवाहित हो सकते हैं |
| अंतरा-कण आकर्षण बल | सबसे प्रबल | ठोस से दुर्बल | नगण्य |
| कणों की गतिज ऊर्जा | न्यूनतम | ठोस से अधिक | सर्वाधिक |
4. अवस्था परिवर्तन
तापमान या दाब बदलकर पदार्थ की अवस्था बदली जा सकती है।
- गलन (Melting): ठोस से द्रव। जिस तापमान पर यह होता है उसे गलनांक कहते हैं।
- हिमीकरण (Freezing): द्रव से ठोस। इसका तापमान हिमांक (गलनांक के बराबर) होता है।
- क्वथन (Boiling): द्रव से गैस। जिस तापमान पर यह होता है उसे क्वथनांक कहते हैं।
- संघनन (Condensation): गैस से द्रव।
- उर्ध्वपातन (Sublimation): बिना द्रव बने सीधे ठोस से गैस में बदलना (उदा., कपूर, अमोनियम क्लोराइड)।
5. गुप्त ऊष्मा
- वह छुपी हुई ऊष्मा जो अवस्था परिवर्तन के दौरान बिना तापमान बदले अवशोषित या मुक्त होती है।
- संगलन की गुप्त ऊष्मा: 1 kg ठोस को उसके गलनांक पर द्रव में बदलने के लिए आवश्यक ऊष्मा।
- वाष्पन की गुप्त ऊष्मा: 1 kg द्रव को उसके क्वथनांक पर वाष्प में बदलने के लिए आवश्यक ऊष्मा।
6. वाष्पन
- वह प्रक्रिया जिसमें एक द्रव अपने क्वथनांक से कम तापमान पर और अपनी सतह से वाष्प में बदलता है।
- वाष्पन को प्रभावित करने वाले कारक:
- सतह का क्षेत्रफल: सतह का क्षेत्रफल बढ़ने पर वाष्पन बढ़ता है।
- तापमान: तापमान बढ़ने पर वाष्पन बढ़ता है।
- आर्द्रता: आर्द्रता बढ़ने पर वाष्पन घटता है।
- वायु की गति: वायु की गति बढ़ने पर वाष्पन बढ़ता है।
- वाष्पन का शीतलन प्रभाव: जब कोई द्रव वाष्पित होता है तो उच्चतम गतिज ऊर्जा वाले कण पहले पलायन करते हैं, जिससे बचे हुए कणों की औसत गतिज ऊर्जा (तापमान) कम हो जाती है। इससे शीतलता होती है।
- उदाहरण: पसीना सूखने पर हमें ठंडक महसूस होती है।
महत्वपूर्ण प्रश्न एवं उत्तर (Important Questions & Answers)
अति लघु उत्तरीय प्रश्न (1 अंक)
1. पदार्थ को परिभाषित करें।
उत्तर: वह सब कुछ जिसमें द्रव्यमान हो और स्थान घेरता हो, पदार्थ कहलाता है।
2. वह प्रक्रिया क्या है जिससे जल की एक बूंद बीकर के पानी में फैल जाती है?
उत्तर: विसरण (Diffusion)।
3. निम्नलिखित पर जल की भौतिक अवस्था क्या है: a) 25°C b) 0°C c) 100°C?
उत्तर: a) द्रव, b) ठोस (बर्फ) या द्रव, c) गैस (भाप) या द्रव।
4. तापमान का SI मात्रक क्या है?
उत्तर: केल्विन (K)।
5. एक वायुमंडलीय दाब पर जल का क्वथनांक क्या है?
उत्तर: 100°C (373 K)।
6. बर्फ वाले ठंडे पानी से भरे गिलास की बाहरी सतह पर पानी की बूंदें क्यों दिखाई देती हैं?
उत्तर: हवा में मौजूद जलवाष्प गिलास की ठंडी बाहरी सतह के संपर्क में आती है, ऊर्जा खो देती है और संघनित होकर पानी की बूंदों में बदल जाती है।
7. उस प्रक्रिया का सामान्य नाम क्या है जहाँ एक ठोस सीधे गैस में बदल जाता है?
उत्तर: उर्ध्वपातन (Sublimation)।
लघु उत्तरीय प्रश्न (2-3 अंक)
1. बर्फ के पिघलने के दौरान तापमान स्थिर क्यों रहता है?
उत्तर: पिघलने के दौरान तापमान स्थिर रहता है क्योंकि आपूर्ति की गई ऊष्मा ऊर्जा बर्फ के कणों के बीच के आकर्षण बलों (गुप्त ऊष्मा) पर काबू पाने के लिए उपयोग होती है। यह ऊर्जा ठोस की दृढ़ संरचना को तोड़कर द्रव में बदल देती है बिना गतिज ऊर्जा (और इसलिए तापमान) बढ़ाए।
2. वाष्पन ठंडक कैसे पैदा करता है?
उत्तर: वाष्पन के दौरान, द्रव के कण आकर्षण बल पर काबू पाने और वाष्प में बदलने के लिए परिवेश से ऊर्जा अवशोषित करते हैं। द्रव की सतह को छोड़ने वाले कण उच्च गतिज ऊर्जा वाले होते हैं। इन उच्च-ऊर्जा वाले कणों के निकल जाने से बचे हुए कणों की औसत गतिज ऊर्जा कम हो जाती है, जिससे तापमान कम होता है और ठंडक होती है।
3. गैसों में संपीड्यता अधिक क्यों होती है लेकिन ठोसों में नहीं?
उत्तर: गैसों में कणों के बीच बहुत large रिक्त स्थान होते हैं। जब दबाव लगाया जाता है, तो इन कणों को एक-दूसरे के closer धकेला जा सकता है, जिससे आयतन कम हो जाता है। ठोसों में, कणों के बीच बहुत कम जगह होती है, जिससे वे असंपीड्य होते हैं।
4. हम गर्मियों में सूती कपड़े क्यों पहनते हैं?
उत्तर: सूती कपड़ा पानी (पसीना) का अच्छा अवशोषक होता है। गर्मियों में, हमें अधिक पसीना आता है। पसीना सूती कपड़े द्वारा अवशोषित कर लिया जाता है और एक बड़े surface area पर फैल जाता है, जिससे वाष्पन तेज होता है। यह वाष्पन ठंडक पैदा करता है, जिससे हमें आराम महसूस होता है।
5. निम्नलिखित तापमान को केल्विन पैमाने में बदलें: a) 25°C b) 373°C
उत्तर: °C को K में बदलने के लिए: K = °C + 273
a) 25°C = 25 + 273 = 298 K
b) 373°C = 373 + 273 = 646 K
दीर्घ उत्तरीय प्रश्न (5 अंक)
1. ठोस, द्रव और गैस के गुणों की तुलना करें।
उत्तर: (संक्षिप्त नोट्स अनुभाग में दी गई तालिका देखें)। आकार, आयतन, घनत्व, संपीड्यता, प्रवाहिता, अंतरा-कण बल और गतिज ऊर्जा जैसे गुणों का उल्लेख करें।
2. a) गुप्त ऊष्मा क्या है? संगलन की गुप्त ऊष्मा और वाष्पन की गुप्त ऊष्मा में अंतर बताएं।
b) आप कैसे दिखाएंगे कि हवा में जलवाष्प मौजूद है?
उत्तर:
a) गुप्त ऊष्मा: किसी पदार्थ की अवस्था बदलने के लिए आवश्यक ऊष्मा ऊर्जा, बिना तापमान बदले, गुप्त ऊष्मा कहलाती है।
- संगलन की गुप्त ऊष्मा: 1 kg ठोस को उसके गलनांक पर द्रव में बदलने के लिए आवश्यक ऊष्मा ऊर्जा।
- वाष्पन की गुप्त ऊष्मा: 1 kg द्रव को उसके क्वथनांक पर वाष्प में बदलने के लिए आवश्यक ऊष्मा ऊर्जा।
b) एक गिलास ठंडा पानी लें और उसे एक मेज पर रख दें। कुछ देर बाद, हम गिलास की बाहरी सतह पर पानी की बूंदें देखेंगे। ऐसा इसलिए होता है क्योंकि हवा में मौजूद जलवाष्प गिलास की ठंडी सतह के संपर्क में आती है, ऊर्जा खो देती है और द्रव जल में परिवर्तित हो जाती है (संघनन)। यह हवा में जलवाष्प की उपस्थिति साबित करता है।
3. एक गतिविधि describe करें जो दर्शाती है कि surface area बढ़ने पर वाष्पन की दर बढ़ जाती है।
उत्तर:
- उद्देश्य: वाष्पन पर surface area के प्रभाव को दिखाना।
- सामग्री: दो पेट्री डिश/प्लेट, पानी की समान मात्रा।
- विधि:
- दो पेट्री डिश लें। उन पर A और B अंकित करें।
- डिश A में 10 ml पानी डालें और डिश B में भी 10 ml पानी डालें।
- डिश A को यूं ही छोड़ दें (छोटा surface area)। डिश B के पानी को एक चम्मच से फैला दें ताकि surface area बढ़ जाए।
- दोनों डिश को एक ही जगह पर कुछ समय के लिए छोड़ दें।
- अवलोकन: डिश B का पानी (बड़े surface area वाला), डिश A के पानी की तुलना में पहले पूरी तरह वाष्पित हो जाएगा।
- निष्कर्ष: surface area बढ़ने पर वाष्पन की दर बढ़ जाती है।



